
【题目】普通干电池,是一种广泛使用的可移动化学电源,其结构如图甲所示,电池反应是:![]() 但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
实验一、用废锌制取防腐剂皓矾![]() 图乙
图乙![]()

![]() 操作一的名称是:______。
操作一的名称是:______。
![]() 锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物
锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物![]() 四羟基锌酸钠
四羟基锌酸钠![]() 和
和![]() ,该配合物中心离子是______,配位数是 ______。
,该配合物中心离子是______,配位数是 ______。
实验二、经查相关资料:锰的氧化物都不溶于水,且都能与浓盐酸反应生成氯气.将分离得到的黑色粉末在空气中充分灼烧,并做相关实验,回答下列问题:
![]() 灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物
灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物![]() 和
和![]() 。
。
![]() 写出
写出![]() 与浓盐酸反应的离子方程式: ______ 。
与浓盐酸反应的离子方程式: ______ 。
![]() 取
取![]() 上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气
上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气![]() ,则混合物中
,则混合物中![]() 和
和![]() 质量之比是: ______ 。
质量之比是: ______ 。
实验三、查询资料得知,还可以通过电解的方式,将![]() 转化为
转化为![]() ,同学们设计了这样的一个装置
,同学们设计了这样的一个装置![]() 图丙
图丙![]() ,将混合物粉末调成糊状,附在其中的 ______ 边电极上
,将混合物粉末调成糊状,附在其中的 ______ 边电极上![]() 填左或者右
填左或者右![]() ,该电极上发生的电极反应式是: ______
,该电极上发生的电极反应式是: ______ ![]() 在电解过程中溶液的pH将 ______填变大、变小、不变
在电解过程中溶液的pH将 ______填变大、变小、不变![]() 。
。
【答案】蒸发浓缩、冷却结晶 ![]() 4 除去混合物中的碳
4 除去混合物中的碳 ![]() 158:55 左
158:55 左 ![]() 变大
变大
【解析】
实验一:![]() 由流程可知,操作一是由硫酸锌溶液得到晶体;
由流程可知,操作一是由硫酸锌溶液得到晶体;
(2)![]() 由
由![]() 通过配位键与4个OH-结合;
通过配位键与4个OH-结合;
实验二:![]() 分离得到的黑色粉末含有锰的氧化物和碳粉;
分离得到的黑色粉末含有锰的氧化物和碳粉;
(2)![]() 与浓盐酸反应生成氯化锰、氯气和水;
与浓盐酸反应生成氯化锰、氯气和水;
(3)根据电子守恒计算![]() 和
和![]() 物质的量比;
物质的量比;
实验三:![]() 转化为
转化为![]() 发生氧化反应,混合物附在阳极上,根据总反应判断pH变化;
发生氧化反应,混合物附在阳极上,根据总反应判断pH变化;
实验一:![]() 由流程可知,由硫酸锌溶液得到晶体,则操作一为蒸发浓缩、冷却结晶;
由流程可知,由硫酸锌溶液得到晶体,则操作一为蒸发浓缩、冷却结晶;
![]() 配合物
配合物![]() 中,
中, ![]() 由
由![]() 通过配位键与4个OH-结合,
通过配位键与4个OH-结合,![]() 为中心离子,
为中心离子,![]() 为配体,配位数为4;
为配体,配位数为4;
实验二:![]() 混合物灼烧时C转化为二氧化碳气体,与固体分离,所以灼烧的目的是除去混合物中的碳;
混合物灼烧时C转化为二氧化碳气体,与固体分离,所以灼烧的目的是除去混合物中的碳;
![]() 与浓盐酸反应,生成氯化锰、氯气和水,离子反应为
与浓盐酸反应,生成氯化锰、氯气和水,离子反应为![]() ;
;
![]() 设
设![]() 和
和![]() 的物质的量分别为x、y,则
的物质的量分别为x、y,则
由质量关系可知![]() ,
,
由电子守恒可知,![]() ,
,
解得![]() ,物质的量相同,可知摩尔质量之比等于质量比,则
,物质的量相同,可知摩尔质量之比等于质量比,则![]() 和
和![]() 质量比为158:55;
质量比为158:55;
实验三:通过电解的方式,将![]() 转化为
转化为![]() ,在阳极上失去电子实现转化,由图可知,左侧与电源正极相连为阳极,则将混合物粉末调成糊状,附在其中的左边电极上,该电极上发生的电极反应式是:
,在阳极上失去电子实现转化,由图可知,左侧与电源正极相连为阳极,则将混合物粉末调成糊状,附在其中的左边电极上,该电极上发生的电极反应式是:![]() ,阴极氢离子放电,
,阴极氢离子放电,![]() ,总反应消耗水,最终氢氧根离子浓度增大,则在电解过程中溶液的pH将变大。
,总反应消耗水,最终氢氧根离子浓度增大,则在电解过程中溶液的pH将变大。


科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置。(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)。
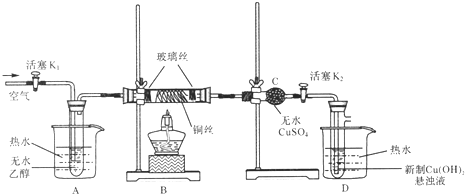
请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:_____________;
(2)对A中的乙醇采用水浴加热的目的是____________;
(3)实验时,点燃B处的酒精灯后,先____________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是____________,发生的主要反应的化学方程式为____________,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个____________反应(填“吸热”或“放热”).
(4)装置C的作用是____________,能在此处观察到的现象是____________;
(5)装置D中的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示装置的判断,叙述正确的是( )

A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I已知:还原性HSO![]() >I-,氧化性IO
>I-,氧化性IO![]() > I2 。
> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目_______。
囗NaIO3+囗NaHSO3→ 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式_______;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为_______mol。

II 已知:KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2、KHSO4等物质。写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol![]() 和2mol
和2mol![]() 气体,充入固定体积的密闭容器,在一定条件下发生下列反应:
气体,充入固定体积的密闭容器,在一定条件下发生下列反应:![]() ,平衡时
,平衡时![]() 为nmol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时
为nmol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时![]() 的物质的量一定大于nmol的是
的物质的量一定大于nmol的是![]()
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molCl(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )

A.生成lmolH2(g)中的H-H键吸收436kJ能量B.H2(g)+Cl2(g)=2HCl(g) △H=-864kJ·mol-1
C.图示此反应为吸热反应D.HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g) △H=92.5kJ·mol-1
Cl2(g) △H=92.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)( 正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
2SO3(g)( 正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
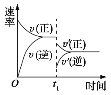
A.降低体系温度B.减小生成物的浓度
C.催化剂失效D.增大容器的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com