
【题目】将2mol![]() 和2mol
和2mol![]() 气体,充入固定体积的密闭容器,在一定条件下发生下列反应:
气体,充入固定体积的密闭容器,在一定条件下发生下列反应:![]() ,平衡时
,平衡时![]() 为nmol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时
为nmol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时![]() 的物质的量一定大于nmol的是
的物质的量一定大于nmol的是![]()
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【答案】C
【解析】
在一定条件下,将2mol SO2和2mol SO3气体充入固定体积的密闭容器,发生反应,![]() 可以看做与起始量为4mol SO2,1molO2 反应达到平衡是相同的平衡状态,各物质的浓度不变,物质的量不变,SO3为nmol;
可以看做与起始量为4mol SO2,1molO2 反应达到平衡是相同的平衡状态,各物质的浓度不变,物质的量不变,SO3为nmol;
A、起始充入2molSO2和1molO2,相当于在原平衡基础上减少了2molSO2,减少反应物二氧化硫的量,平衡逆向进行,消耗三氧化硫;
B、4molSO2和1molO2正好与原平衡相同;
C、起始充入2molSO2和1molO2和2molSO3,相当于起始加入了4molSO2和2molO2,可看做在原平衡的基础上加入1molO2,平衡正向移动,三氧化硫增加;
D、起始充入3molSO2和1molSO3,相当于起始加入了4molSO2和0.5molO2,可看做在原平衡的基础上减少了0.5molO2,平衡逆向进行,消耗三氧化硫。
A、起始量和题给起始量相比,相当于减少![]() ,减少反应物二氧化硫的量,平衡逆向进行,三氧化硫物质的量
,减少反应物二氧化硫的量,平衡逆向进行,三氧化硫物质的量![]() ,故A不符合;
,故A不符合;
B、起始量与题给起始量相同,平衡相同,![]() 物质的量为n mol,故B不符合;
物质的量为n mol,故B不符合;
C、起始量相当于加入![]() 和
和![]() ,可看做在原平衡的基础上加入
,可看做在原平衡的基础上加入![]() ,平衡正向移动,三氧化硫物质的量
,平衡正向移动,三氧化硫物质的量
![]() ,故C符合;
,故C符合;
D、起始量相当于起始加入了![]() 和
和![]() ,可看做在原平衡的基础上减少了
,可看做在原平衡的基础上减少了![]() ,平衡逆向进行,三氧化硫物质的量
,平衡逆向进行,三氧化硫物质的量![]() ,故D不符合;
,故D不符合;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成nmolCO,同时生成nmolH2
D.断裂1molH—H键的同时断裂2molH—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通干电池,是一种广泛使用的可移动化学电源,其结构如图甲所示,电池反应是:![]() 但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
但这种一次性电池使用后的随意丢弃,已经是不可忽视的环境问题.某中学的课外活动小组在老师指导下,用废弃的电池进行处理回收.将电池剥离,得到石墨棒,清洗后作电化学实验的电极.废锌皮和炭黑与锰的氧化物做以下处理
实验一、用废锌制取防腐剂皓矾![]() 图乙
图乙![]()

![]() 操作一的名称是:______。
操作一的名称是:______。
![]() 锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物
锌的化学性质与铝相似,也可以与强碱反应而溶解,但生成的是配合物![]() 四羟基锌酸钠
四羟基锌酸钠![]() 和
和![]() ,该配合物中心离子是______,配位数是 ______。
,该配合物中心离子是______,配位数是 ______。
实验二、经查相关资料:锰的氧化物都不溶于水,且都能与浓盐酸反应生成氯气.将分离得到的黑色粉末在空气中充分灼烧,并做相关实验,回答下列问题:
![]() 灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物
灼烧的目的是: ______ ,将灼烧后的固体冷却,溶解、过滤、干燥得到的固体物质混合物![]() 和
和![]() 。
。
![]() 写出
写出![]() 与浓盐酸反应的离子方程式: ______ 。
与浓盐酸反应的离子方程式: ______ 。
![]() 取
取![]() 上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气
上述混合物,与足量的浓盐酸充分反应,得到标况下的氯气![]() ,则混合物中
,则混合物中![]() 和
和![]() 质量之比是: ______ 。
质量之比是: ______ 。
实验三、查询资料得知,还可以通过电解的方式,将![]() 转化为
转化为![]() ,同学们设计了这样的一个装置
,同学们设计了这样的一个装置![]() 图丙
图丙![]() ,将混合物粉末调成糊状,附在其中的 ______ 边电极上
,将混合物粉末调成糊状,附在其中的 ______ 边电极上![]() 填左或者右
填左或者右![]() ,该电极上发生的电极反应式是: ______
,该电极上发生的电极反应式是: ______ ![]() 在电解过程中溶液的pH将 ______填变大、变小、不变
在电解过程中溶液的pH将 ______填变大、变小、不变![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,M、N 两种气体的物质的量随时间变化的曲线如图所示:

(1)反应的化学方程式为_______________。
(2)反应达到最大限度的时间是______min,该时间内的平均反应速率v(N)=______。
(3)反应达到平衡状态时,放中6QkJ的热量,当容器中充入lmolN,反应放出的热量为_____。
①等于QkJ ②小于QkJ ③大于QkJ ④等于2QkJ
(4)判断该反应达到平衡状态的依据是__________。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的密度不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2molN的同时,生成1molM
(5)能能加快反应速率的措施是_________。
①升高温度 ②容器体积不变,充入隋性气体Ar
③容器压強不变,充入惰性气体Ar ④使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2A(g)+3B(g)![]() C(g)+4D(g),速率最快的是( )
C(g)+4D(g),速率最快的是( )
A. v(C)=0.1mol·L-1·s-1 B. v(B)=4.0 mol·L-1·min-1
C. v(A)=2.0mol·L-1·min-1 D. v(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知NaOH(aq)+HCl(aq)=![]()
![]() H=-57.3
H=-57.3![]() 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) ![]() H=-483.6
H=-483.6![]()
![]() 则氢气的燃烧热为241.8
则氢气的燃烧热为241.8![]()
C.已知![]() =
=![]()
![]() H=a
H=a![]()
![]() ===2CO(g)
===2CO(g)![]() H=b
H=b![]() 则a>b
则a>b
D.已知P(白磷,s)=P(红磷,s)![]() H<0,则白磷比红磷稳定
H<0,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是_____;
(2)已知2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
2SO3(g)△H=﹣196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在2L容积固定不变的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=___ ;
②在①的条件下,判断该反应达到平衡状态的标志是____(填字母).
a.SO2、O2、SO3三者的浓度之比为2:1:2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)
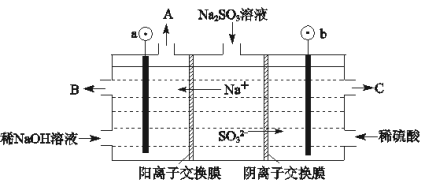
①图中a极要连接电源的(填“正”或“负”)____ 极,C口流出的物质是____;
②SO32﹣放电的电极反应式为 _________ ;
③电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为 _________ g(假设该过程中所有液体进出口密闭)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填空:
(1)写出![]() 中含氧官能团的名称_______________;
中含氧官能团的名称_______________;
(2)![]() 属于__________类化合物;
属于__________类化合物;
(3)CH2=CH—CH3在催化剂加热条件下生成聚合物的反应方程式为________;
(4)写出实验室制乙炔的化学反应方程式_________________;
(5)①称取3.4g某有机化合物A,完全燃烧后生成1.8g H2O和8.8g CO2,已知该有机物的蒸气对氢气的相对密度为68,则该有机物的分子式为_________________;
②该有机物A的核磁共振氢谱和红外光谱如下:

试推测有机物A的结构简式为_________________________;
③与A属于同类有机物的同分异构体包括A共有_________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com