
【题目】一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成nmolCO,同时生成nmolH2
D.断裂1molH—H键的同时断裂2molH—O键
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
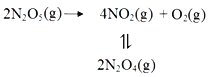
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g)![]() 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的 △H=________kJ· mol-1。
O2(g)的 △H=________kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________。
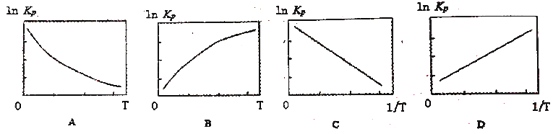
(3)25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:
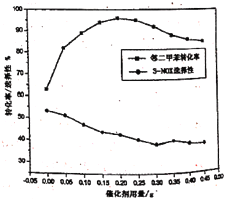
①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。
![]() 已知
已知![]() 与水反应生成乙炔。请回答下列问题:
与水反应生成乙炔。请回答下列问题:
![]() 将乙炔通入
将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀,
红棕色沉淀,![]() 基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成
基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成![]() 和Cu,但CuO在高温下会分解成
和Cu,但CuO在高温下会分解成![]() ,试从结构角度解释高温下CuO何会生成
,试从结构角度解释高温下CuO何会生成![]() :______。
:______。
![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 中含有的
中含有的![]() 键数目为 ______ 。
键数目为 ______ 。
![]() 乙炔与氢氰酸反应可得丙烯腈
乙炔与氢氰酸反应可得丙烯腈![]() 丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
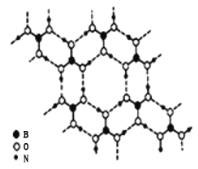
![]() 硼酸
硼酸![]() 是一种片层状结构的白色晶体,层内的
是一种片层状结构的白色晶体,层内的![]() 分子间通过氢键相连
分子间通过氢键相连![]() 如图
如图![]() 则
则![]() 的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸
的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸![]() ,它电离生成少量
,它电离生成少量![]() 和
和![]() ,则
,则![]() 含有的化学键类型为 ______ 。
含有的化学键类型为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置。(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)。
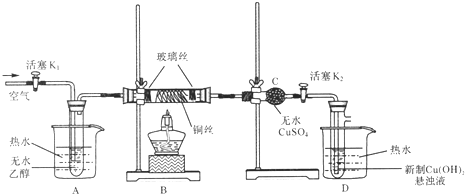
请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:_____________;
(2)对A中的乙醇采用水浴加热的目的是____________;
(3)实验时,点燃B处的酒精灯后,先____________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是____________,发生的主要反应的化学方程式为____________,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个____________反应(填“吸热”或“放热”).
(4)装置C的作用是____________,能在此处观察到的现象是____________;
(5)装置D中的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将0.1 mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8 g,后者增重22 g(假定气体全部吸收)。试通过计算推断该烃的分子式_________(要有计算过程)。若该烃的一氯代物只有一种,试写出该烃的结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分反应的产物已略去)。A只含两种元素,摩尔质量为72g·mol1。B是无色气体,其水溶液是常见的酸,C是常见金属,E的组成元素与水相同,其水溶液常用于实验室制氧气,H的俗名是熟石灰,J为红褐色固体。

(1)A的化学式为___。
(2)D的电子式为___。
(3)写出反应③的离子方程式:___。
(4)写出反应④的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钠是常见的消毒剂,实验室可用以下两种方法来制取次氯酸钠溶液:
方法一:向装有NaOH的溶液中通入氯气(装置如图所示);

方法二:向Na2CO3溶液中加入Ca(ClO)2,反应后过滤。
(1)写出方法一所发生反应的离子方程式___。
(2)NaOH溶液和氯气的反应为放热反应,随着温度的升高,会有副反应发生。为防止副反应的发生,可以采取的方法是___。
(3)方法二与方法一相比,优点除无副反应发生外,还有___、___。
(4)某次氯酸钠粗产品中混有的杂质为NaClO3,为测定粗产品中NaClO的质量分数,现进行如下实验:称取0.6173g样品于锥形瓶中,加水使样品完全溶解,向溶液中加入适量硫酸酸化,接着加入40mL0.5000mol·L-1的FeSO4溶液(过量),充分反应。再向锥形瓶中滴加0.0200mol·L-1的KMnO4溶液,恰好完全反应时消耗KMnO4溶液体积28.00mL。请计算样品中NaClO的质量分数(写出计算过程)。___
已知实验过程中发生的反应如下:
H++ClO-+Fe2+→Cl-+Fe3++H2O
H++ClO3-+Fe2+→Cl-+Fe3++H2O
H++MnO4-+Fe2+→Mn2++Fe3++H2O(以上反应均未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol![]() 和2mol
和2mol![]() 气体,充入固定体积的密闭容器,在一定条件下发生下列反应:
气体,充入固定体积的密闭容器,在一定条件下发生下列反应:![]() ,平衡时
,平衡时![]() 为nmol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时
为nmol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时![]() 的物质的量一定大于nmol的是
的物质的量一定大于nmol的是![]()
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com