
【题目】现将0.1 mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8 g,后者增重22 g(假定气体全部吸收)。试通过计算推断该烃的分子式_________(要有计算过程)。若该烃的一氯代物只有一种,试写出该烃的结构简式______。
【答案】C5H12 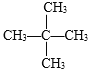
【解析】
浓硫酸具有吸水性,浓硫酸增重10.8 g为水的质量,可求得烃中H原子个数,生成物通入NaOH溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式,然后根据该烃的一氯代物只有一种,说明分子中只含有一种H原子,确定物质结构简式。
浓硫酸具有吸水性,浓硫酸增重10.8 g为水的质量,则n(H2O)=![]() =0.6 mol,n(H)=2n(H2O)=2×0.6 mol=1.2 mol;生成物通入NaOH溶液,增重的22 g为CO2的质量,则n(CO2)=
=0.6 mol,n(H)=2n(H2O)=2×0.6 mol=1.2 mol;生成物通入NaOH溶液,增重的22 g为CO2的质量,则n(CO2)=![]() =0.5 mol,n(C)=n(CO2)=0.5 mol,即0.1 mol烃中含有1.2 mol H原子,0.5 mol C原子,则1 mol该烃中含有5 mol C原子和12 mol H原子,该烃分子中C原子数为5,H原子个数为12,因此该烃的分子式为C5H12;若该烃的一氯代物只有一种,说明物质分子中只含有一种位置的H原子,其结构简式为:
=0.5 mol,n(C)=n(CO2)=0.5 mol,即0.1 mol烃中含有1.2 mol H原子,0.5 mol C原子,则1 mol该烃中含有5 mol C原子和12 mol H原子,该烃分子中C原子数为5,H原子个数为12,因此该烃的分子式为C5H12;若该烃的一氯代物只有一种,说明物质分子中只含有一种位置的H原子,其结构简式为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为____个,能量最高的电子占据的能级符号为__。
(2)磷的一种同素异形体—白磷(P4)的立体构型为____,推测其在CS2中的溶解度____(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:________。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:______。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____,已知晶体的密度为pg·cm-3,阿伏加德罗常数为NA,则晶胞边长为____cm(用含p、NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据官能团可以对有机物进行分类、鉴别和除杂。
①下列有机物属于烃的是___(填字母)。
a.乙炔 b.乙醇 c.乙酸
②区分甲苯和苯,可用的试剂是___(填字母)。
a.FeCl3溶液 b.酸性KMnO4溶液 c.溴水
③除去乙酸乙酯中的乙酸,可用的试剂是___(填字母)。
a.NaOH溶液 b.NaCl溶液 c.饱和Na2CO3溶液
(2)异丙苯是一种重要的有机化工原料。异丙苯的结构简式为![]() 。
。
①异丙苯中最多有___个碳原子共平面,其核磁共振氢谱上有___个峰。
②异丙苯氧化后可制取分子式为C6H6O的芳香族化合物,该化合物的结构简式是___。
③异丙苯制备对溴异丙苯的化学方程式为___。
(3)化合物III是一种合成医药的中间体,其合成路线如下:
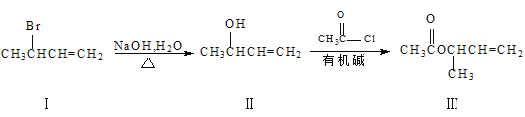
①III中所含官能团的名称是___和___。
②该合成路线中第二步反应属于___反应(填反应类型)。
③I、Ⅱ、Ⅲ三种物质中,与浓硫酸共热能得到CH2=CHCH=CH2的是___(填序号)。物质Ⅱ在Cu作催化剂及加热条件下与O2反应可得产物为___。
④Ⅲ的一种同分异构体X能发生银镜反应,不能发生水解反应,分子中有3种不同化学环境的氢。X的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。
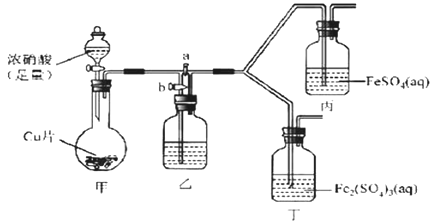
Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成nmolCO,同时生成nmolH2
D.断裂1molH—H键的同时断裂2molH—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40molB.0.20mol
C.小于0.20molD.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,M、N 两种气体的物质的量随时间变化的曲线如图所示:

(1)反应的化学方程式为_______________。
(2)反应达到最大限度的时间是______min,该时间内的平均反应速率v(N)=______。
(3)反应达到平衡状态时,放中6QkJ的热量,当容器中充入lmolN,反应放出的热量为_____。
①等于QkJ ②小于QkJ ③大于QkJ ④等于2QkJ
(4)判断该反应达到平衡状态的依据是__________。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的密度不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2molN的同时,生成1molM
(5)能能加快反应速率的措施是_________。
①升高温度 ②容器体积不变,充入隋性气体Ar
③容器压強不变,充入惰性气体Ar ④使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com