
����Ŀ����1�����ݹ����ſ��Զ��л�����з��ࡢ����ͳ��ӡ�
�������л�������������___������ĸ����
a����Ȳ b���Ҵ� c������
�����ּױ��ͱ������õ��Լ���___������ĸ����
a��FeCl3��Һ b������KMnO4��Һ c����ˮ
�۳�ȥ���������е����ᣬ���õ��Լ���___������ĸ����
a��NaOH��Һ b��NaCl��Һ c������Na2CO3��Һ
��2���������һ����Ҫ���л�����ԭ�ϡ�������Ľṹ��ʽΪ![]() ��
��
��������������___��̼ԭ�ӹ�ƽ�棬��˴Ź�����������___���塣
����������������ȡ����ʽΪC6H6O�ķ����廯����û�����Ľṹ��ʽ��___��
��������Ʊ�����������Ļ�ѧ����ʽΪ___��
��3��������III��һ�ֺϳ�ҽҩ���м��壬��ϳ�·�����£�
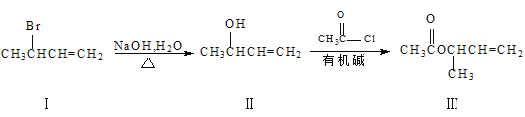
��III�����������ŵ�������___��___��
�ڸúϳ�·���еڶ�����Ӧ����___��Ӧ���Ӧ���ͣ���
��I�������������У���Ũ���Ṳ���ܵõ�CH2��CHCH��CH2����___������ţ������ʢ���Cu��������������������O2��Ӧ�ɵò���Ϊ___��
�ܢ��һ��ͬ���칹��X�ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ����������3�ֲ�ͬ��ѧ�������⡣X�Ľṹ��ʽΪ___��
���𰸡�a b c 8 5 ![]()
![]() +Br2
+Br2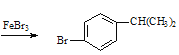 +HBr ���� ̼̼˫�� ȡ�� ��
+HBr ���� ̼̼˫�� ȡ�� �� ![]()
![]() ����OHCCH2CH2CH2CH2CHO��
����OHCCH2CH2CH2CH2CHO��
��������
��1��������ֻ��C��HԪ�أ�
�ڱ�������������Һ��Ӧ�����ױ��ܱ��������������Һ��������ʹ����ɫ��
�۳�ȥ���������е����ᣬ��ѡ����̼���ƣ������ᷴӦ���ҽ��������������ܽ�ȣ�
��2���ٱ���Ϊƽ��ṹ���뱽��ֱ��������C��ͬһƽ���ڣ���ֻ��8��Cԭ�ӹ��棻��������3�ֲ�ͬ��������ԭ�ӣ������������ֲ�ͬ��������ԭ�ӣ���˴Ź�����������5���壻
��C6H6O�в����Ͷ�![]() =4������������4�������Ͷȣ�˵��������û��˫������һ���ǻ���
=4������������4�������Ͷȣ�˵��������û��˫������һ���ǻ���
��������Ʊ���������������巢��ȡ����FeBr3��������
��3����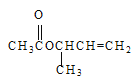 �й�������������̼̼˫����
�й�������������̼̼˫����
���ɺϳ����̿�֪����������±������ˮ�ⷴӦ����������ȡ����Ӧ��OH��CH3COȡ�����úϳ�·���еڶ�����Ӧ����ȡ����Ӧ��
�ۢ��о��ɷ�����ȥ��Ӧ���ɲ������Ļ��������ȥ��Ӧ��������ͬ����Ũ���Ṳ���ܵõ�CH2��CHCH��CH2���� ��
��
�ܻ�������һ��ͬ���칹��X�ܷ���������Ӧ�Ҳ�����ˮ�⣬X�ķ�������3�ֲ�ͬ��ѧ�������⣬X��ֻ����ȩ����û������������Ϊ�����к�3��λ�õ�H�����Է�����һ���ĶԳ��ԣ�
��1��������ֻ��C��HԪ�أ�ֻ��a���ϣ�b��c�к�OԪ�أ��ʴ�Ϊ��a��
��a. �������Ȼ���������Ӧ����������ˮ���ܶȾ���ˮ��С��������ͬ�����ܼ��𣬹�A����
b. ��������������Һ��Ӧ�����ױ��ܱ��������������Һ��������ʹ����ɫ������ͬ���ܼ��𣬹�B��ȷ��
c. ��������ˮ��Ӧ��������ȡ��������ͬ�����ܼ��𣬹�C����
��ȷ����b��
�۳�ȥ���������е����ᣬ��ѡ����̼���ƣ������ᷴӦ���ҽ��������������ܽ�ȣ���ѡc��
��2���ٱ���Ϊƽ��ṹ���뱽��ֱ��������C��ͬһƽ���ڣ�������3��ԭ�ӿɹ��棬��ֻ��8��Cԭ�ӹ��棬��������3�ֲ�ͬ��������ԭ�ӣ������������ֲ�ͬ��������ԭ�ӣ���˴Ź�����������5���塣�ʴ�Ϊ��8��5��
��C6H6O�в����Ͷ�![]() =4������������4�������Ͷȣ�˵��������û��˫������һ���ǻ����û�����Ľṹ��ʽ��
=4������������4�������Ͷȣ�˵��������û��˫������һ���ǻ����û�����Ľṹ��ʽ��![]() ��
��
��������Ʊ���������������巢��ȡ����FeBr3���������ʴ�Ϊ��![]() +Br2
+Br2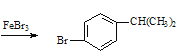 +HBr��
+HBr��
��3����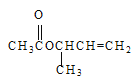 �й�������������̼̼˫����
�й�������������̼̼˫����
���ɺϳ����̿�֪����������±������ˮ�ⷴӦ����������ȡ����Ӧ��OH��CH3COȡ�����úϳ�·���еڶ�����Ӧ����ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ��
�ۢ��о��ɷ�����ȥ��Ӧ���ɲ������Ļ��������ȥ��Ӧ��������ͬ����Ũ���Ṳ���ܵõ�CH2��CHCH��CH2���� �� �ʴ�Ϊ����
�� �ʴ�Ϊ����
�ܻ�������һ��ͬ���칹��X�ܷ���������Ӧ�Ҳ�����ˮ�⣬X�ķ�������3�ֲ�ͬ���������⣬X��ֻ����ȩ����û������������Ϊ�����к�3��λ�õ�H�����Է�����һ���ĶԳ��ԣ���XΪ![]() ����OHCCH2CH2CH2CH2CHO����
����OHCCH2CH2CH2CH2CHO����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ���� (����)
A. ϡ���������Ƭ�ϣ�2Fe��6H��===2Fe3����3H2��
B. ̼��������Һ��ϡ�����ϣ�HCO3-+H+=H2O+CO2��
C. ����ͭ��Һ������������Һ��ϣ�CuSO4��2OH��===Cu(OH)2����![]()
D. ��������Һ���Ȼ�����Һ��ϣ�AgNO3��Cl��===AgCl����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪Na2S2O3��H2SO4=Na2SO4��S����SO2����H2O����ͬѧͨ���ⶨ�÷�Ӧ����ʱ��Һ����ǵ�ʱ�䣬�о���������Ի�ѧ��Ӧ���ʵ�Ӱ�졣���ʵ��һ���£���ȡ��Һ�����Ϊ10 mL����
ʵ���� | ʵ���¶�/�� | c��Na2S2O3��/ ��mol��L��1�� | c��H2SO4��/ ��mol��L��1�� |
�� | 25 | 0��1 | 0��1 |
�� | 25 | 0��2 | 0��1 |
�� | 25 | 0��1 | 0��2 |
�� | 50 | 0��2 | 0��1 |
�� | 50 | 0��1 | 0��1 |
������������ʱ��̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��ʵ��____________����ʵ���ţ�����ͬʱѡ��ʵ��١�ʵ��ڡ�ʵ��ۣ��ⶨ���Һ����ǵ�ʱ�䣬��̽��______________�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��2����һ���¶��£�����4a mol H2��2a mol N2����V L���ܱ������У�5 min����N2��ת����Ϊ50%����ö�ʱ����H2��ʾ�ķ�Ӧ����Ϊ______________________
ʵ�������֪2KMnO4��5H2C2O4��3H2SO4=K2SO4��2MnSO4��8H2O��10CO2�����ڿ�ʼһ��ʱ���ڣ���Ӧ���ʽ�С����Һ��ɫ�����ԣ�������ͻȻ��ɫ����Ӧ������������
��3�������������ijͬѧ��Ϊ�÷�Ӧ���ȣ�������Һ�¶���������Ӧ��������Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������뻹������______________________��Ӱ�졣
��4������ʵ��֤����IJ��룬�����Ը��������Һ��������Һ�⣬�����ڷ�Ӧһ��ʼʱ����______________������ĸ��ţ���
A�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ء���Ԫ�ء�ͭԪ���ڻ�ѧ���к���Ҫ�ĵ�λ�����ʼ��仯�����ڹ�ũҵ�������������й㷺��Ӧ�á�
![]() ��֪
��֪![]() ��ˮ��Ӧ������Ȳ����ش��������⣺
��ˮ��Ӧ������Ȳ����ش��������⣺
![]() ����Ȳͨ��
����Ȳͨ��![]() ��Һ������
��Һ������![]() ����ɫ������
����ɫ������![]() ��̬��������Ų�ʽΪ ______ ������������Һ�в��ȶ����ɷ����绯��Ӧ����
��̬��������Ų�ʽΪ ______ ������������Һ�в��ȶ����ɷ����绯��Ӧ����![]() ��Cu����CuO�ڸ����»�ֽ��
��Cu����CuO�ڸ����»�ֽ��![]() ���Դӽṹ�ǶȽ�������CuO�λ�����
���Դӽṹ�ǶȽ�������CuO�λ�����![]() ��______��
��______��
![]() ��
��![]() ��
��![]() ��Ϊ�ȵ����壬
��Ϊ�ȵ����壬![]() �к��е�
�к��е�![]() ����ĿΪ ______ ��
����ĿΪ ______ ��
![]() ��Ȳ�������ᷴӦ�ɵñ�ϩ��
��Ȳ�������ᷴӦ�ɵñ�ϩ��![]() ��ϩ�������̼ԭ�ӹ���ӻ������� ______ �����ɱ�ϩ��Ԫ���е�һ������������ ______ ��
��ϩ�������̼ԭ�ӹ���ӻ������� ______ �����ɱ�ϩ��Ԫ���е�һ������������ ______ ��
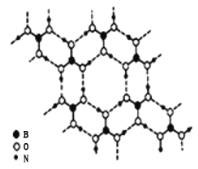
![]() ����
����![]() ��һ��Ƭ��״�ṹ�İ�ɫ���壬���ڵ�
��һ��Ƭ��״�ṹ�İ�ɫ���壬���ڵ�![]() ���Ӽ�ͨ���������
���Ӽ�ͨ���������![]() ��ͼ
��ͼ![]() ��
��![]() �ľ������� ______ mol�������������ˮ�����������һˮ������
�ľ������� ______ mol�������������ˮ�����������һˮ������![]() ����������������
����������������![]() ��
��![]() ����
����![]() ���еĻ�ѧ������Ϊ ______ ��
���еĻ�ѧ������Ϊ ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ����Һ������H2O ��CCl4��I2��I-�ȣ��л��յ⣬�����������£�
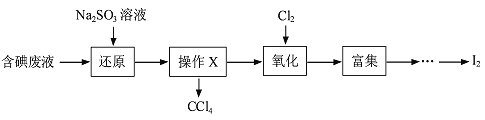
��1�����Һ�м���Na2SO3��Һ����������ԭ����Ӧ�����ӷ���ʽΪ____________��
��2����������������������ƿ�н��У���ͼһ��������Һ���������pHԼΪ2������ͨ��Cl2��ʵ����ˮԡ������40�����ҵĽϵ��¶��½��е�ԭ����_______��
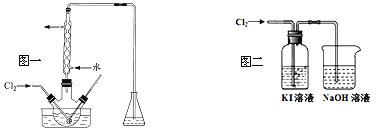
��3��ij�о�С����ͼ��װ�ö�Cl2��KI��Һ�ķ�Ӧ����̽��������ͨ��Cl2һ��ʱ���KI��Һ��Ϊ��ɫ������ͨ��Cl2������Һ��ɫ��dz������Ϊ��ɫ���о�С���������ɫ��Һ�е�Ԫ�صĴ�����̬��������¼��裺
����һ��û��I2��̬���������û��I����̬������������IO3����̬��
�������ʵ��֤������һ�������Լ���ѡ����
ʵ����� | Ԥ������ | ���� |
___________________ | ����һ���� |
������������������д������IO3�������ӷ���ʽ__________________________________��
��4�����о�С�黹�����˶Լӵ�����KIO3�����ⶨ������ʵ�飺
��ȷ��ȡ�ӵ���m g���ձ��У�������������ˮ������KI���ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250.00mL������Һ����ȡ25.00mL������Һ����ƿ�У��Ӽ��ε�����Һ����c molL-1Na2S2O3��Һ�ζ����յ㣬�ظ�3�Σ����ƽ��ֵΪV mL��
��֪��IO3��+ 5I��+6H+ =3H2O+3I2��I2 +2S2O32��=2I��+S4O62�����ⶨʱ���жϴﵽ�ζ��յ������Ϊ___________���ɲⶨ���ݿ���ø���Ʒ�к�KIO3����������Ϊ___________���ú�m��c��V�Ĵ���ʽ��ʾ��Mr��KIO3��=214 ����
���ڵζ�������ȷ���������£��ô��ֲⶨ������õĽ������ƫ�ߣ���ԭ�����ܿ�����Ӱ�죬�������ӷ���ʽ��ʾ������һӰ���ԭ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йش����Ĵ�����������ɴ����Ҵ�������ʵ�����õ�һЩ��ʶ����ͼ��ij��ѧ��ȤС����Ƶ��Ҵ���������ʵ��װ����(��ʾ��ͨ�������Ƶ�Cu(OH)2����Һ����ש��ɫ���������������к���ȩ��)��
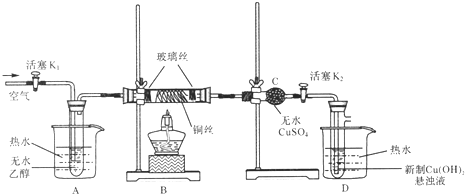
���ͼ�ش��������⣺
��1���������Ӱ�װ��ϣ�����ʵ��ǰ��μ���װ�õ������ԣ���_____________��
��2����A�е��Ҵ�����ˮԡ���ȵ�Ŀ����____________��
��3��ʵ��ʱ����ȼB���ľƾ��ƺ���____________���ټ��л������ͭ˿�������װ���в��ϵػ��������������ʱB�й۲쵽��������____________����������Ҫ��Ӧ�Ļ�ѧ����ʽΪ____________������Ӧ����һ��ʱ�����ȥ�ƾ��ƣ��������ϻ����ع��������B�����ظ���������˵��B�������ķ�Ӧ��һ��____________��Ӧ(��������������������)��
��4��װ��C��������____________�����ڴ˴��۲쵽��������____________��
��5��װ��D�е�������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�0.1 molij����ȫȼ�����ɵ�����ȫ������ͨ��Ũ���������������Һ�����ⶨ��ǰ������10.8 g����������22 g(�ٶ�����ȫ������)����ͨ�������ƶϸ����ķ���ʽ_________(Ҫ�м������)����������һ�ȴ���ֻ��һ�֣���д�������Ľṹ��ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������dz�������������ʵ���ҿ����������ַ�������ȡ����������Һ��
����һ����װ��NaOH����Һ��ͨ��������װ����ͼ��ʾ����

����������Na2CO3��Һ�м���Ca(ClO)2����Ӧ����ˡ�
��1��д������һ��������Ӧ�����ӷ���ʽ___��
��2��NaOH��Һ�������ķ�ӦΪ���ȷ�Ӧ�������¶ȵ����ߣ����и���Ӧ������Ϊ��ֹ����Ӧ�ķ��������Բ�ȡ�ķ�����___��
��3���������뷽��һ��ȣ��ŵ������Ӧ�����⣬����___��___��
��4��ij�������ƴֲ�Ʒ�л��е�����ΪNaClO3��Ϊ�ⶨ�ֲ�Ʒ��NaClO�������������ֽ�������ʵ�飺��ȡ0.6173g��Ʒ����ƿ�У���ˮʹ��Ʒ��ȫ�ܽ⣬����Һ�м������������ữ�����ż���40mL0.5000mol��L��1��FeSO4��Һ������������ַ�Ӧ��������ƿ�еμ�0.0200mol��L��1��KMnO4��Һ��ǡ����ȫ��Ӧʱ����KMnO4��Һ���28.00mL���������Ʒ��NaClO������������д��������̣���___
��֪ʵ������з����ķ�Ӧ���£�
H����ClO����Fe2����Cl����Fe3����H2O
H����ClO3-��Fe2����Cl����Fe3����H2O
H����MnO4-��Fe2����Mn2����Fe3����H2O�����Ϸ�Ӧ��δ��ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˼ά�ǻ�ѧ�����г��õ�һ��˼ά�����������йط�Ӧ����ʽ�������ӷ���ʽ����������ȷ���ǣ�������
��֪ | ���� | |
A | ��Fe����CuSO4��Һ�У� Fe + Cu2+ = Cu + Fe2+ | ��Na���뵽CuSO4��Һ�У� 2Na + Cu2+ = Cu + 2Na+ |
B | ϡ������Ba(OH)2��Һ��Ӧ����Һ�����ԣ� 2H++SO42��+Ba2++2OH��=BaSO4��+2H2O | NaHSO4��Һ��Ba(OH)2��Һ��Ӧ�����ԣ� 2H++SO42��+Ba++2OH��=BaSO4��+2H2O |
C | ����������Ӧ2Fe+3Cl2 | ���͵��ʷ�Ӧ2Fe+3I2 |
D | ��Ca��ClO��2��Һ��ͨ������CO2�� Ca2++2ClO��+CO2+H2O=CaCO3��+2HClO | ��Ca��ClO��2��Һ��ͨ������SO2�� Ca2++2ClO��+SO2+H2O=CaSO3��+2HClO |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com