
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
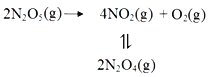
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g)![]() 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的 △H=________kJ· mol-1。
O2(g)的 △H=________kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________。
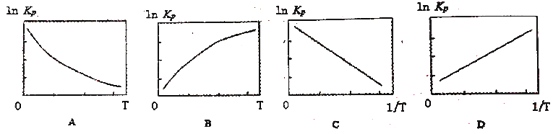
(3)25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:
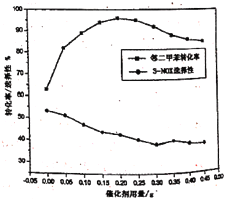
①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________。
【答案】+53.1 大于 温度升高,容器容积不变,且二氧化氮二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 13.4 BC 反应一定时间并未达到平衡状态,当催化加用量在0-0.20g时随着用量的增加反应速率加快,邻二甲苯转化率增加;当催化剂用量超过0.20g时大量的催化剂可能会催化N2O5的分解,导致邻二甲苯转化率降低 
【解析】
(1) 已①2N2O5(g)=2N2O4(g)+O2(g)△H1=4.4kJ/mol、②2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,根据盖斯定律可知,![]() ①②即得到N2O5(g)=2NO2(g)+
①②即得到N2O5(g)=2NO2(g)+![]() O2(g),据此计算△H的值;
O2(g),据此计算△H的值;
(2)温度升高,容器容积不变,且二氧化氮二聚为吸热反应,温度提高,平衡右移,体系物质的量增加,总压强提高;
(3)根据五氧化二氮完全分解时的压强计算出二氧化氮、氧气的压强,然后再根据二氧化氮转化的方程式计算平衡时二氧化氮、四氧化二氮的压强;根据2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,反应吸热,升高温度,平衡右移,平衡常数增大,则平衡常数的对数增大,但不是线性关系;升高温度,T增大,![]() 减小,平衡左移,平衡常数减小,则平衡常数的对数减小,线性关系;
减小,平衡左移,平衡常数减小,则平衡常数的对数减小,线性关系;
(4) ①根据图像,反应一定时间并未达到平衡状态,当催化加用量在0-0.20g时随着用量的增加反应速率加快,邻二甲苯转化率增加;当催化剂用量超过0.20g时大量的催化剂可能会催化N2O5的分解,导致邻二甲苯转化率降低;
②根据题意,邻二甲苯在催化剂作用下经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX),催化剂的用量影响邻二甲苯反应发生转化进行的方向,根据图像显示,催化剂用量越多,3-硝基邻二甲苯(3-NOX)生成量越少,反应越向着生成4-硝基邻二甲苯(4-NOX)反应进行,二者的生成量应关于邻二甲苯的转化率50%呈对称分布,或者说二者生成之和为100%,根据3-硝基邻二甲苯(3-NOX)选择性曲线呈对称分布画出曲线;
(1) 已①2N2O5(g)=2N2O4(g)+O2(g)△H1=4.4kJ/mol、②2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,根据盖斯定律可知,![]() ①②即得到N2O5(g)=2NO2(g)+
①②即得到N2O5(g)=2NO2(g)+![]() O2(g)△H=+53.1kJ/mol,
O2(g)△H=+53.1kJ/mol,
故答案为:+53.1;
(2)由于温度升高,容器容积不变,总压强提高,且二氧化氮二聚为吸热反应,温度提高,平衡右移,体系物质的量增加,总压强提高,所以若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)大于63.1kPa,
故答案为:大于;温度升高,容器容积不变,且二氧化氮二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高;
(3)根据表中数据可知五氧化二氮完全分解时的压强是63.1kPa,根据方程式可知完全分解时最初生成的二氧化氮的压强是35.8kPa×2=71.6kPa,氧气是35.8kPa×![]() =17.9kPa,总压强应该是71.6kPa+17.9kPa=89.5kPa,平衡后压强减少了89.5kPa63.1kPa=26.4kPa,所以根据方程式2NO2(g)N2O4(g)可知,平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6kPa26.4kPa×2=18.8kPa,则反应的平衡常数Kp=
=17.9kPa,总压强应该是71.6kPa+17.9kPa=89.5kPa,平衡后压强减少了89.5kPa63.1kPa=26.4kPa,所以根据方程式2NO2(g)N2O4(g)可知,平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6kPa26.4kPa×2=18.8kPa,则反应的平衡常数Kp=![]() ≈13.4kPa;根据2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,反应吸热,升高温度,平衡右移,平衡常数增大,则平衡常数的对数增大,但不是线性关系;升高温度,T增大,
≈13.4kPa;根据2NO2(g)=N2O4(g)△H2=+55.3kJ/mol,反应吸热,升高温度,平衡右移,平衡常数增大,则平衡常数的对数增大,但不是线性关系;升高温度,T增大,![]() 减小,平衡左移,平衡常数减小,则平衡常数的对数减小,线性关系,故答案选BC。
减小,平衡左移,平衡常数减小,则平衡常数的对数减小,线性关系,故答案选BC。
故答案为:13.4;BC;
(4) ①根据图像,反应一定时间并未达到平衡状态,当催化加用量在0-0.20g时随着用量的增加反应速率加快,邻二甲苯转化率增加;当催化剂用量超过0.20g时大量的催化剂可能会催化N2O5的分解,导致邻二甲苯转化率降低,
故答案为:反应一定时间并未达到平衡状态,当催化加用量在0-0.20g时随着用量的增加反应速率快,邻二甲苯转化率增加;当催化剂用量超过0.20g时大量的催化剂可能会催化N2O5的分解,导致邻二甲苯转化率降低;
②根据题意,邻二甲苯在催化剂作用下经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX),催化剂的用量影响邻二甲苯反应发生转化进行的方向,根据图像显示,催化剂用量越多,3-硝基邻二甲苯(3-NOX)生成量越少,反应越向着生成4-硝基邻二甲苯(4-NOX)反应进行,二者的生成量应关于邻二甲苯的转化率50%呈对称分布,或者说二者生成之和为100%,则4-NOX的选择性随催化剂用量变化的曲线为 ,
,
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下:
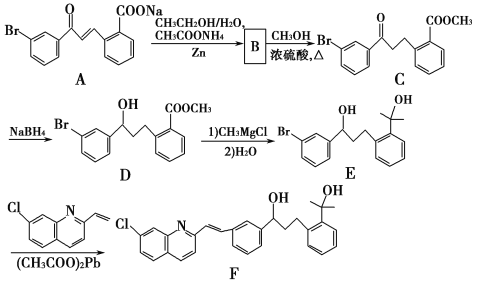
请回答下列问题:
(1)化合物B的分子式为C16H13O3Br,B的结构简式为_________。
(2)由C→D、E→F的反应类型依次为_________、_________。
(3)写出符合下列条件C的一种同分异构体的结构简式_________。
Ⅰ属于芳香族化合物,且分子中含有2个苯环
Ⅱ能够发生银镜反应
Ⅲ分子中有5种不同环境的氢原子。
(4)已知:RCl![]() RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、![]() 为原料制备
为原料制备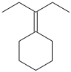 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例见本题题干。____________
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例见本题题干。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铜锌原电池构造示意图,其电池反应式为 Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s), 下列判断不正确的是
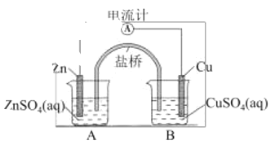
A.Zn 为负极B.盐桥中的阳离子移向B
C.移去盐桥,电流计指针不偏转D.铜棒质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C、D、E、F、G 七种元素,试按如下所给的条件推断:
①A、B、C 是同一周期的金属元素,已知原子核外有3个电子层,A 的原子半径在所属周期中最大,且原子半径:A>B>C;
②D、E 是非金属元素,它们与氢化合可生成气态氢化物 HD 和 HE,室温下,D 的单质是液体,E 的单质是固体;
③F是地壳中含量最多的元素,G 是非金属性最强的元素
(1)C 离子的结构示意图为________________________ ;E 单质的颜色为_________。
(2)用电子式表示B、D 元素形成的化合物的形成过程:_____________________________ 。
(3)有 G、F 元素参加的置换反应的化学方程式为___________________________ 。
(4)用离子方程式证明D、E 元素的非金属性强弱,并用单线桥表示电子转移的方向和数目:________________________。
(5)用刺孔的 C单质(足量)包裹住2.3gA 单质放于水中,标准状况下,收集到气体的体积最多为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、 铜及其化合物在工业上有重要用途, 回答下列问题:
(1) 请补充完基态Co的简化电子排布式: [Ar]_________, Co2+有_______个未成对电子。
(2) Na3[Co(NO2)6]常用作检验K+的试剂, 配位体NO2-的中心原子的杂化形式为________, 空间构型为_____。大π键可用符号![]() 表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ),则NO2-中大π键应表示为____________。
),则NO2-中大π键应表示为____________。
(3) 配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是______________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是______________________________________________________。

(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为______, 铜的原子半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为_________g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下:
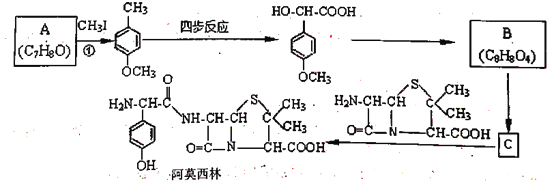
已知:1.两个羟基同时连在同一个碳原子上的结构是不稳定的,它将发生脱水反应
![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]()
(1)关于阿莫西林分子,下列说法正确的是_______________。
A.分子式为C16H18N3O5 B.分子中含4个手性碳原子
C.1 mol该物质最多能与3mol NaOH反应 D.能发生取代、加成、氧化、缩聚等反应
(2)反应①的化学方程式为_______________,CH3I的作用为__________。
(3)写出甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式: ________。
(4)试写出3种同时满足下列条件的化合物C的同分异构体:___________。
①分子中含苯环,不含过氧键“-O-O-”;
②分子中含有3种不同化学环境的氢原子。
(5)利用己有知识和题中涉及的反应,设计从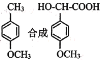 的路线。(用流程图表示,无机试剂任选)__________________
的路线。(用流程图表示,无机试剂任选)__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
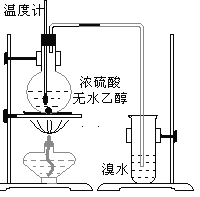
(1)写出甲同学实验中两个反应的化学方程式:_____________、___________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
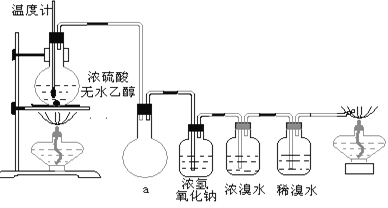
①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述不能说明该反应已达到化学平衡状态的是( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成nmolCO,同时生成nmolH2
D.断裂1molH—H键的同时断裂2molH—O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com