
【题目】化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下:
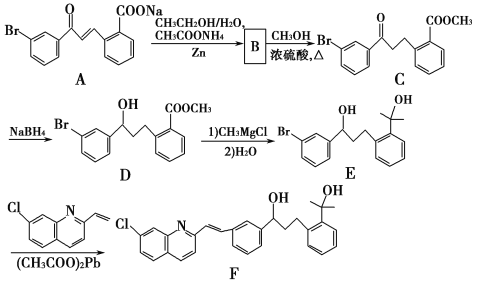
请回答下列问题:
(1)化合物B的分子式为C16H13O3Br,B的结构简式为_________。
(2)由C→D、E→F的反应类型依次为_________、_________。
(3)写出符合下列条件C的一种同分异构体的结构简式_________。
Ⅰ属于芳香族化合物,且分子中含有2个苯环
Ⅱ能够发生银镜反应
Ⅲ分子中有5种不同环境的氢原子。
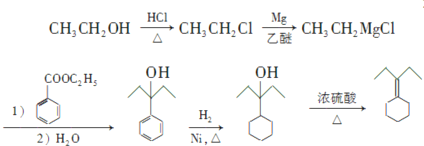
(4)已知:RCl![]() RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、![]() 为原料制备
为原料制备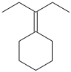 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例见本题题干。____________
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例见本题题干。____________
【答案】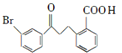 加成反应 取代反应
加成反应 取代反应 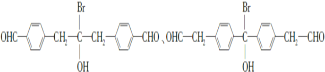
【解析】
B发生酯化反应生成C,根据C结构简式知,B结构简式为 ,C发生加成反应生成D,D反应生成E,E发生取代反应生成F。
,C发生加成反应生成D,D反应生成E,E发生取代反应生成F。
(1)B发生酯化反应生成C,根据C结构简式知,B结构简式为 ;
;
(2)根据合成过程可知,![]() :加成反应,
:加成反应,![]() :取代反应;
:取代反应;
(3)C的同分异构体符合下列条件:Ⅰ属于芳香族化合物,且分子中含有2个苯环;Ⅱ能够发生银镜反应说明含有醛基;Ⅲ分子中有5种不同环境的氢原子;可得到:
符合条件的同分异构体结构简式为 ;
;
(4)已知:![]() 可知,
可知,![]() 与
与![]() 发生取代反应生成
发生取代反应生成![]() ,
,![]() 与
与![]() 、乙醚反应生成
、乙醚反应生成![]() ,
,![]() 与
与
![]() 反应,然后水解生成
反应,然后水解生成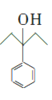 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成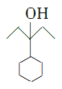 ,
, 在浓硫酸加热条件下发生消去反应,生成
在浓硫酸加热条件下发生消去反应,生成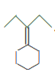 ,
,
其合成线路流程为:


科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示.下列说法正确的是
与pH的关系如图所示.下列说法正确的是![]()
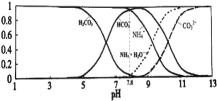
A.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
B.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
C.往该溶液中逐滴滴加氢氧化钠时![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.通过分析可知常温下![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示:
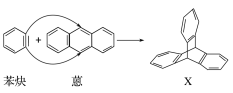
(1)蒽与X都属于________(填字母)。
A.环烃 B.烃 C.不饱和烃
(2)苯炔的分子式为__________,苯炔不具有的性质是__________(填字母)。
A.能溶于水 B.能发生氧化反应
C.能发生加成反应 D.常温常压下为气体
(3)下列属于苯的同系物的是________(填字母,下同)。
A. ![]() B.
B. 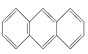 C.
C. ![]() D.
D. ![]()
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是________。
A. ![]() B.C6H14 C.
B.C6H14 C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生1:1加成的产物有两种:
①CH2Cl—CHCl—CH=CH2(1,2—加成) ②CH2Cl—CH=CH—CH2Cl (1,4—加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的1:1加成产物有几种(不考虑顺反异构和镜像异构( )
A. 6种B. 10种C. 12种D. 14种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3-
B.c(NO3-)=1mol/L的溶液中:H+、Fe2+、SO42-、Cl-
C.中性溶液中:NH4+、Fe3+、SO42-、Cl-
D.![]() =1×1012的溶液中:K+、Na+、S2O32-、F-
=1×1012的溶液中:K+、Na+、S2O32-、F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应![]() ,
,![]() 为金属
为金属![]() ,下列推断中不正确的是
,下列推断中不正确的是![]()
![]()
A.BrCl同![]() 、
、![]() 具有相似的化学性质
具有相似的化学性质
B.常温下,BrCl可与NaOH反应生成NaCl和NaBrO
C.BrCl跟水的反应是氧化还原反应
D.BrCl的氧化性强于![]() ,弱于
,弱于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是![]()
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了![]() 等碘的氧化物
等碘的氧化物
C.已经制得了![]() 、
、![]() 等含
等含![]() 离子的离子化合物
离子的离子化合物
D.碘单质![]() 在通常情况下为具有金属光泽的紫黑色固体
在通常情况下为具有金属光泽的紫黑色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于同一反应类型的是
A.由液态油脂制人造脂肪;由乙烷制氯乙烷
B.由甲苯制TNT;由地沟油制生物柴油
C.由乙醇制乙醛;由1,![]() 丁二烯合成顺丁橡胶
丁二烯合成顺丁橡胶
D.由苯制溴苯;由溴乙烷制乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
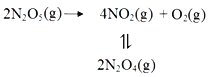
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g)![]() 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的 △H=________kJ· mol-1。
O2(g)的 △H=________kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________。
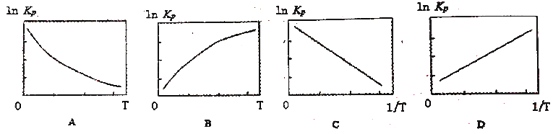
(3)25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:
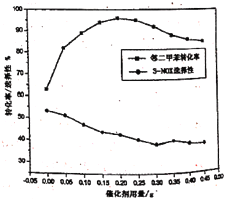
①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com