
【题目】由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是![]()
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了![]() 等碘的氧化物
等碘的氧化物
C.已经制得了![]() 、
、![]() 等含
等含![]() 离子的离子化合物
离子的离子化合物
D.碘单质![]() 在通常情况下为具有金属光泽的紫黑色固体
在通常情况下为具有金属光泽的紫黑色固体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4;2NaCl+H2SO4![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S;Na2SO4+4C![]() Na2S+4CO↑
Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3;Na2S+CaCO3![]() Na2CO3+CaS
Na2CO3+CaS
下列说法正确的是( )
A.②③两步都是氧化还原反应
B.只有第②步是氧化还原反应
C.该方法对生产设备基本没有腐蚀
D.该方法对环境污染较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为1 molSO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ·mol-1、E2=y kJ·mol-1,下列有关说法中不正确的是( )
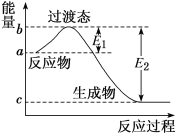
A.若在反应体系中加入催化剂,E1减小
B.若在反应体系中加入催化剂,ΔH不变
C.反应的活化能等于x kJ·mol-1
D.2SOCl2(g)=SO2Cl2(g)+SCl2(g) ΔH=(x-y)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下:
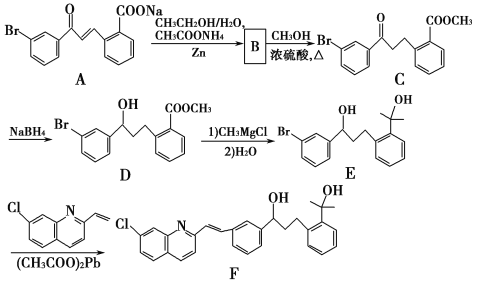
请回答下列问题:
(1)化合物B的分子式为C16H13O3Br,B的结构简式为_________。
(2)由C→D、E→F的反应类型依次为_________、_________。
(3)写出符合下列条件C的一种同分异构体的结构简式_________。
Ⅰ属于芳香族化合物,且分子中含有2个苯环
Ⅱ能够发生银镜反应
Ⅲ分子中有5种不同环境的氢原子。
(4)已知:RCl![]() RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、![]() 为原料制备
为原料制备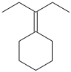 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例见本题题干。____________
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例见本题题干。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述正确的是( )
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.反应达到平衡时,反应物的转化率一定小于100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组利用CO2催化氢化制甲烷,研究发现HCOOH是CO2转化为CH4的中间体,即:![]() ,镍粉是反应I、II的催化剂。CH4、HCOOH、H2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
,镍粉是反应I、II的催化剂。CH4、HCOOH、H2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
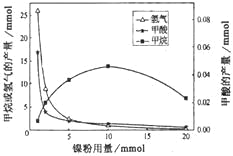
由图可知,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )
A.反应I的速率增加,反应II的速率不变
B.反应I的速率不变,反应II的速率增加。
C.反应I、II的速率均增加,且反应I的速率增加得快
D.反应I、II的速率均增加,且反应II的速率增加得快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铜锌原电池构造示意图,其电池反应式为 Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s), 下列判断不正确的是
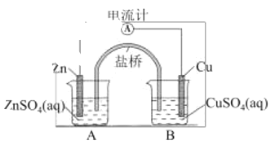
A.Zn 为负极B.盐桥中的阳离子移向B
C.移去盐桥,电流计指针不偏转D.铜棒质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下:
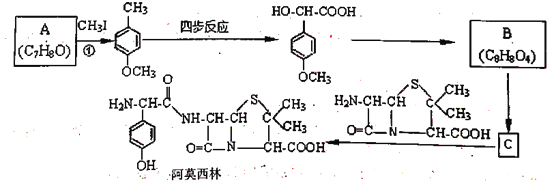
已知:1.两个羟基同时连在同一个碳原子上的结构是不稳定的,它将发生脱水反应
![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]()
(1)关于阿莫西林分子,下列说法正确的是_______________。
A.分子式为C16H18N3O5 B.分子中含4个手性碳原子
C.1 mol该物质最多能与3mol NaOH反应 D.能发生取代、加成、氧化、缩聚等反应
(2)反应①的化学方程式为_______________,CH3I的作用为__________。
(3)写出甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式: ________。
(4)试写出3种同时满足下列条件的化合物C的同分异构体:___________。
①分子中含苯环,不含过氧键“-O-O-”;
②分子中含有3种不同化学环境的氢原子。
(5)利用己有知识和题中涉及的反应,设计从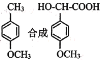 的路线。(用流程图表示,无机试剂任选)__________________
的路线。(用流程图表示,无机试剂任选)__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com