
【题目】如图是铜锌原电池构造示意图,其电池反应式为 Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s), 下列判断不正确的是
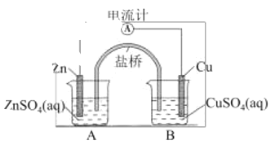
A.Zn 为负极B.盐桥中的阳离子移向B
C.移去盐桥,电流计指针不偏转D.铜棒质量不变
科目:高中化学 来源: 题型:
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示:
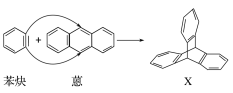
(1)蒽与X都属于________(填字母)。
A.环烃 B.烃 C.不饱和烃
(2)苯炔的分子式为__________,苯炔不具有的性质是__________(填字母)。
A.能溶于水 B.能发生氧化反应
C.能发生加成反应 D.常温常压下为气体
(3)下列属于苯的同系物的是________(填字母,下同)。
A. ![]() B.
B. 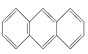 C.
C. ![]() D.
D. ![]()
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是________。
A. ![]() B.C6H14 C.
B.C6H14 C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是![]()
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了![]() 等碘的氧化物
等碘的氧化物
C.已经制得了![]() 、
、![]() 等含
等含![]() 离子的离子化合物
离子的离子化合物
D.碘单质![]() 在通常情况下为具有金属光泽的紫黑色固体
在通常情况下为具有金属光泽的紫黑色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于同一反应类型的是
A.由液态油脂制人造脂肪;由乙烷制氯乙烷
B.由甲苯制TNT;由地沟油制生物柴油
C.由乙醇制乙醛;由1,![]() 丁二烯合成顺丁橡胶
丁二烯合成顺丁橡胶
D.由苯制溴苯;由溴乙烷制乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是形成物种最多的元素之一,其中许多物质对人类来说有着极其重要的作用。

(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世界上最薄却也是最坚硬的纳米材料,同时也是导电性最好的材料(结构如图)。下列物质可能与它反应的是_____(填字母)。
A.氧气 B.单质氟 C.浓硝酸 D.氢氧化钠溶液
(2)另一含碳化合物,其分子式为C3H6S2O,它是一种重要医药中间体,它的核磁共振氢谱见下图左。则它的结构简式为_________。
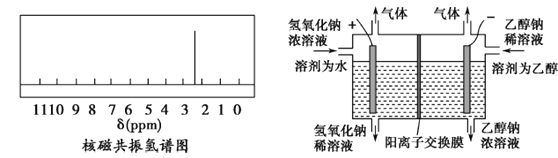
(3)某科研组设计如上图装置,利用电解乙醇和氢氧化钠制取乙醇钠(阳离子交换膜只允许Na+通过)。电解时阳极生成的气体是_________,阴极发生的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:
O3+Cl===ClO+O2 ΔH1
ClO+O===Cl+O2 ΔH2
大气臭氧层的分解反应是:O3+O===2O2 ΔH,该反应的能量变化如图:
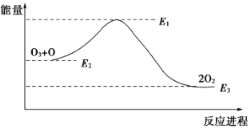
下列叙述中,正确的是
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. ΔH=E3-E2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
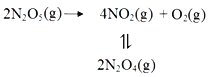
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g)![]() 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的 △H=________kJ· mol-1。
O2(g)的 △H=________kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________。
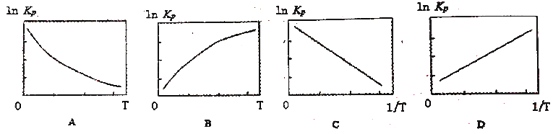
(3)25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:
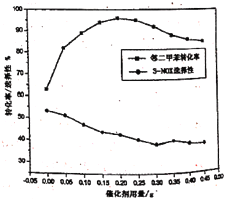
①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。
![]() 已知
已知![]() 与水反应生成乙炔。请回答下列问题:
与水反应生成乙炔。请回答下列问题:
![]() 将乙炔通入
将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀,
红棕色沉淀,![]() 基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成
基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成![]() 和Cu,但CuO在高温下会分解成
和Cu,但CuO在高温下会分解成![]() ,试从结构角度解释高温下CuO何会生成
,试从结构角度解释高温下CuO何会生成![]() :______。
:______。
![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 中含有的
中含有的![]() 键数目为 ______ 。
键数目为 ______ 。
![]() 乙炔与氢氰酸反应可得丙烯腈
乙炔与氢氰酸反应可得丙烯腈![]() 丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
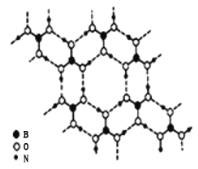
![]() 硼酸
硼酸![]() 是一种片层状结构的白色晶体,层内的
是一种片层状结构的白色晶体,层内的![]() 分子间通过氢键相连
分子间通过氢键相连![]() 如图
如图![]() 则
则![]() 的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸
的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸![]() ,它电离生成少量
,它电离生成少量![]() 和
和![]() ,则
,则![]() 含有的化学键类型为 ______ 。
含有的化学键类型为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com