
【题目】药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下:
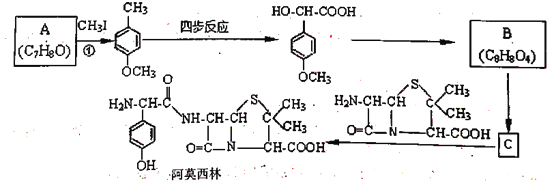
已知:1.两个羟基同时连在同一个碳原子上的结构是不稳定的,它将发生脱水反应
![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]()
(1)关于阿莫西林分子,下列说法正确的是_______________。
A.分子式为C16H18N3O5 B.分子中含4个手性碳原子
C.1 mol该物质最多能与3mol NaOH反应 D.能发生取代、加成、氧化、缩聚等反应
(2)反应①的化学方程式为_______________,CH3I的作用为__________。
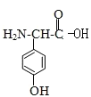
(3)写出甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式: ________。
(4)试写出3种同时满足下列条件的化合物C的同分异构体:___________。
①分子中含苯环,不含过氧键“-O-O-”;
②分子中含有3种不同化学环境的氢原子。
(5)利用己有知识和题中涉及的反应,设计从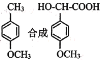 的路线。(用流程图表示,无机试剂任选)__________________
的路线。(用流程图表示,无机试剂任选)__________________
【答案】BD 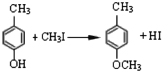 保护酚羟基,防止被氧化
保护酚羟基,防止被氧化 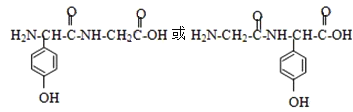
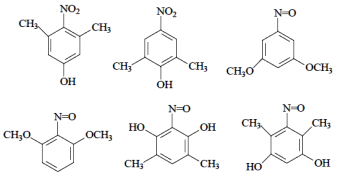 (任写三个)
(任写三个) 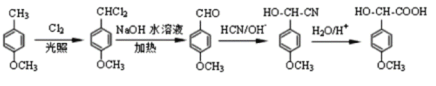
【解析】
(1)根据阿莫西林分子的结构可知分子式,官能团,手性碳的数目;
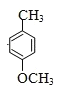
(2)根据①的生成物,推得反应物为对甲基苯酚,与CH3I发生取代反应,酚羟基很容易被氧化,加入CH3I防止被氧化;
(3)C的结构简式为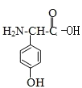 故形成二肽时,羧基失去羟基,氨基失去氢原子;
故形成二肽时,羧基失去羟基,氨基失去氢原子;
(4) 的同分异构体需满足分子式相同,结构不同的有机物,C的分子式为C8H9O3,满足条件①分子中含苯环,不含过氧键“-O-O-”;②分子中含有3种不同化学环境的氢原子,分子中可以含有一个硝基,两个甲基,一个羟基;或者两个甲基,两个羟基,一个氮氧双键;两个CH3O,一个氮氧双键,写出同分异构体的结构。
的同分异构体需满足分子式相同,结构不同的有机物,C的分子式为C8H9O3,满足条件①分子中含苯环,不含过氧键“-O-O-”;②分子中含有3种不同化学环境的氢原子,分子中可以含有一个硝基,两个甲基,一个羟基;或者两个甲基,两个羟基,一个氮氧双键;两个CH3O,一个氮氧双键,写出同分异构体的结构。
(5)  根据题中涉及的反应
根据题中涉及的反应![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]() 制备生成物的工艺流程为:苯环上的甲基转变为醛基,可由取代反应引入氯原子,二元氯代烃在碱性条件下发生取代反应得到含有醛基的有机物,加入氢氰酸,再加酸性条件下水解得到产物。
制备生成物的工艺流程为:苯环上的甲基转变为醛基,可由取代反应引入氯原子,二元氯代烃在碱性条件下发生取代反应得到含有醛基的有机物,加入氢氰酸,再加酸性条件下水解得到产物。
(1)A. 由结构简式可知, 阿莫西林的分子式为C16H19N3O5S,故A错误;
B. 连4个不同基团的原子为手性碳原子,则左侧与氨基,苯环,氢原子,羰基相连的碳原子,四元环上除羰基和氮原子外的两个碳原子均为手性碳,五元环中与羧基相连的碳原子为手性碳,故手性碳共4个,故B正确;
C. 酚OH具有酸性,能与NaOH发生中和反应,COOH能与NaOH发生中和反应,1mol分子中有2mol肽键,在碱性条件下可以水解,则1mol该物质最多可与4molNaOH反应,故B错误。
D. 含有羰基,可发生加成反应,含有苯环和羟基,可发生取代反应,酚羟基可发生氧化反应,含有氨基和羧基,可发生缩聚反应,故D正确;
故答案选BD;
(2)根据分析,A的结构简式为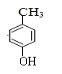 反应方程式为
反应方程式为 ,酚羟基很容易被氧化,加入CH3I防止被氧化;
,酚羟基很容易被氧化,加入CH3I防止被氧化;
故答案为: ;保护酚羟基,防止被氧化;
;保护酚羟基,防止被氧化;
(3) C的结构简式为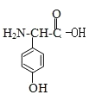 ,C和甘氨酸可以脱水缩合生成肽键,甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式为:
,C和甘氨酸可以脱水缩合生成肽键,甘氨酸(H2N-CH2-COOH)和C发生缩合生成二肽的结构简式为: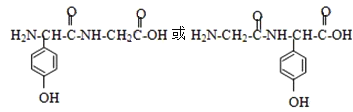 ,
,
故答案为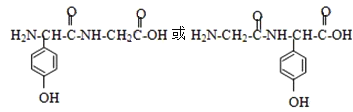 ;
;
(4)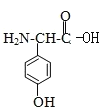 的同分异构体需满足分子式相同,结构不同的有机物,C的分子式为C8H9O3,满足条件①分子中含苯环,不含过氧键“-O-O-”;②分子中含有3种不同化学环境的氢原子,分子中可以含有一个硝基,两个甲基,一个羟基;或者两个甲基,两个羟基,一个氮氧双键;两个CH3O,一个氮氧双键,则符合要求的结构简式为:
的同分异构体需满足分子式相同,结构不同的有机物,C的分子式为C8H9O3,满足条件①分子中含苯环,不含过氧键“-O-O-”;②分子中含有3种不同化学环境的氢原子,分子中可以含有一个硝基,两个甲基,一个羟基;或者两个甲基,两个羟基,一个氮氧双键;两个CH3O,一个氮氧双键,则符合要求的结构简式为: ,
,
故答案为: (任写三个);
(任写三个);
(5)  根据题中涉及的反应
根据题中涉及的反应![]()
![]()
![]() +H2O
+H2O
2.RCHO![]()
![]()
![]()
![]() 制备生成物的工艺流程为:苯环上的甲基转变为醛基,可由取代反应引入氯原子,二元氯代烃在碱性条件下发生取代反应
制备生成物的工艺流程为:苯环上的甲基转变为醛基,可由取代反应引入氯原子,二元氯代烃在碱性条件下发生取代反应
得到含有醛基的有机物,加入氢氰酸,再加酸性条件下水解得到产物,则合成路线图如下: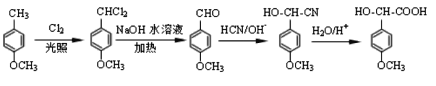 ,
,
故答案为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是![]()
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了![]() 等碘的氧化物
等碘的氧化物
C.已经制得了![]() 、
、![]() 等含
等含![]() 离子的离子化合物
离子的离子化合物
D.碘单质![]() 在通常情况下为具有金属光泽的紫黑色固体
在通常情况下为具有金属光泽的紫黑色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
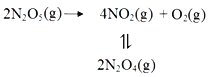
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
(1)已知:2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4 kJ· mol-1
N2O4(g)![]() 2NO2(g) △H2=+55.3 kJ· mol-1
2NO2(g) △H2=+55.3 kJ· mol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的 △H=________kJ· mol-1。
O2(g)的 △H=________kJ· mol-1。
(2)若提高反应温度至35℃,则N2O5(g)完全分解后体系压强介p∞(35℃)______63.1kPa(填“大于”“等于”或“小于”),原因是________________________________________________。
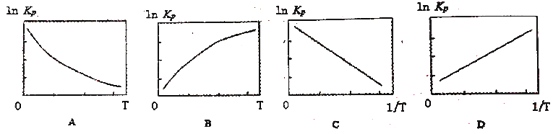
(3)25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
2NO2(g)反应的平衡常数Kp=________kPa (Kp为以分压表示的平衡常数,计算结保留1位小数)。下图中可以示意平衡常数Kp随温度T变化趋势的是_______。
(4)邻二甲苯经硝化得到两种一硝化产物:3-硝基邻二甲苯(3-NOX)和4-硝基邻二甲苯(4-NOX)。某研究小组研究了采用N2O5为硝化剂时催化剂用量对该反应的影响。将一定量的催化剂和邻二甲苯置于反应瓶中,控制温度反应一定时间。测得邻二甲苯的转化率和3-NOX的选择性如图所示:
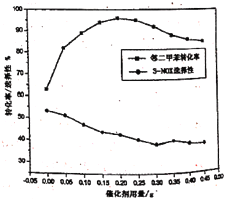
①描述并解释随着催化剂用量的增加,邻二甲苯转化率的变化趋势:____________。
②在图中画出4-NOX的选择性随催化剂用量变化的曲线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)=_____________(用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8(mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq)![]() AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
AgCl(s)+ NO2-(aq)的化学平衡常数K=__________
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为____________。
㈡NaNO2性质探究
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
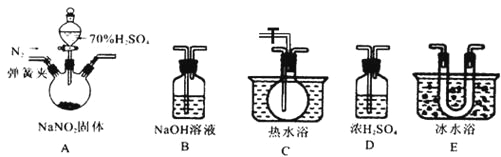
已知: 气体液化的温度:NO221℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→______→ ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用。
![]() 已知
已知![]() 与水反应生成乙炔。请回答下列问题:
与水反应生成乙炔。请回答下列问题:
![]() 将乙炔通入
将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀,
红棕色沉淀,![]() 基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成
基态核外电子排布式为 ______ ,其在酸性溶液中不稳定,可发生歧化反应生成![]() 和Cu,但CuO在高温下会分解成
和Cu,但CuO在高温下会分解成![]() ,试从结构角度解释高温下CuO何会生成
,试从结构角度解释高温下CuO何会生成![]() :______。
:______。
![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 中含有的
中含有的![]() 键数目为 ______ 。
键数目为 ______ 。
![]() 乙炔与氢氰酸反应可得丙烯腈
乙炔与氢氰酸反应可得丙烯腈![]() 丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
丙烯腈分子中碳原子轨道杂化类型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______ 。
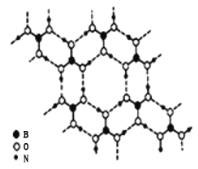
![]() 硼酸
硼酸![]() 是一种片层状结构的白色晶体,层内的
是一种片层状结构的白色晶体,层内的![]() 分子间通过氢键相连
分子间通过氢键相连![]() 如图
如图![]() 则
则![]() 的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸
的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸![]() ,它电离生成少量
,它电离生成少量![]() 和
和![]() ,则
,则![]() 含有的化学键类型为 ______ 。
含有的化学键类型为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钠是常见的消毒剂,实验室可用以下两种方法来制取次氯酸钠溶液:
方法一:向装有NaOH的溶液中通入氯气(装置如图所示);

方法二:向Na2CO3溶液中加入Ca(ClO)2,反应后过滤。
(1)写出方法一所发生反应的离子方程式___。
(2)NaOH溶液和氯气的反应为放热反应,随着温度的升高,会有副反应发生。为防止副反应的发生,可以采取的方法是___。
(3)方法二与方法一相比,优点除无副反应发生外,还有___、___。
(4)某次氯酸钠粗产品中混有的杂质为NaClO3,为测定粗产品中NaClO的质量分数,现进行如下实验:称取0.6173g样品于锥形瓶中,加水使样品完全溶解,向溶液中加入适量硫酸酸化,接着加入40mL0.5000mol·L-1的FeSO4溶液(过量),充分反应。再向锥形瓶中滴加0.0200mol·L-1的KMnO4溶液,恰好完全反应时消耗KMnO4溶液体积28.00mL。请计算样品中NaClO的质量分数(写出计算过程)。___
已知实验过程中发生的反应如下:
H++ClO-+Fe2+→Cl-+Fe3++H2O
H++ClO3-+Fe2+→Cl-+Fe3++H2O
H++MnO4-+Fe2+→Mn2++Fe3++H2O(以上反应均未配平)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com