
【题目】汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程式____
(2)气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是___________。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈_____________。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据:______________。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为______。

(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 =__________kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式____________。
【答案】(1)C8H18![]() C4H10+ C4H8(2分)
C4H10+ C4H8(2分)
(2)①温度升高,反应速率加快,平衡右移(2分) ②4×10-6(2分)
(3)①该反应是焓增、熵减的反应,任何温度下均不能自发进行(2分)
②CO+H2O-2e-=CO2+2H+(2分)
(4)-746(2分) (5) CH3CH=CHCH3+2O3![]() 2CH3CHO +2O2(2分)
2CH3CHO +2O2(2分)
【解析】
试题分析:⑴根据C8H18在高温裂解产生丁烷和丁烯可写出该反应方程式;
⑵①由于生成NO的反应为吸热反应,温度升高,反应速率加快,平衡右移,导致单位时间内NO排放量越大;
②由于题目未告诉容器体积,令其体积为1L,注意数据的近似处理,平衡时: c(N2)≈0.8mol/L, c(O2) ≈0.2mol/L,c(NO)=8×10-8mol/L,将数据代入K=c2(NO)÷[c(N2)·c(O2)]= 4×10-6;
⑶①由于该反应是焓增,熵减的反应,由ΔG=ΔH-TΔS,在任何温度下均不自发进行;
②CO在阳极上发生氧化反应,先根据得失电子守恒有CO-2e-――CO2,再根据电荷守恒有CO-2e-――CO2+2H+,最后根据原子守恒得CO+H2O-2e-=CO2+2H+;
⑷将两式依次编号①②,将“②×2-①”得第三式,根据盖斯定律得第三式的反应热△H3=(-283kJ/mol)×2-(+180kJ/mol)=-746kJ·mol-1;
⑸根据信息“2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气”,应用原子守恒写出该反应方程式。


科目:高中化学 来源: 题型:
【题目】为确定有机物A的结构,某研究团队对有机物A进行了多项实验,得实验结果如下:
①有机物A经李比希法分析知:含碳77.8%,氢为7.40%,其余为氧;
②质谱法分析A得知其相对分子质量为108;
③经红外光谱测定,A分子结构中含有苯环和羟基;
④A的核磁共振氢谱显示其有4种峰,且峰面积比为3∶2∶2∶1;
⑤A为无色晶体,常温下微溶于水;能与烧碱反应,且在常温下A可与浓溴水反应,1 mol A最多可消耗浓溴水中2 mol Br2。
求:(1)该有机物的分子式为________________。
(2)确定该有机物的结构简式:___________________,写出其与足量浓溴水反应的化学方程式:__________。
(3)含有苯环的A的同分异构体还有____________种(不含A),请写出其中属于醇的同分异构体与氧气加热(铜作催化剂)的反应方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4·2H2O![]() 3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
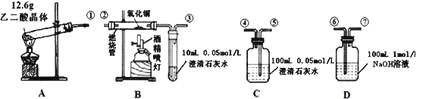
(1)检验装置A气密性的方法是
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:
①→
(3)证明CO存在的实验现象是
(4)本实验尾气处理的方法是
(5)根据题给的数据,假设各反应均充分发生且产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
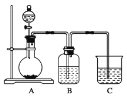
(1)A中反应的离子方程式为________________________________________________,C中可观察到的现象是_____________________________________________________。
(2)B装置的作用是__________________。
(3)根据实验现象推知碳、硅、氮三种元素非金属性的强弱顺序是_____________________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:________________________________________。
(5)C装置的作用是_______________________________________。
(6)实验结论:氧化性:_________________,非金属性:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得达到平衡时的有关数据如下[已知X(g)+3Y(g)![]() 2Z(g) ΔH=Q kJ·mol1]:
2Z(g) ΔH=Q kJ·mol1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol X、3 mol Y | 2 mol Z | 4 mol Z |
Z的浓度(mol·L1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3B. a+b=QC. 2p2<p3D. α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知

A. X、Y、Z中最简单氢化物稳定性最弱的是Y
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8g铁粉加入50mL3mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物和还原产物的物质的量之比为2∶1
D.Fe2+和Fe3+物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏伽德罗常数)( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1molHe含有的原子数目为NA
C.71gCl2所含分子数为2NA
D.在同温同压下,相同体积的任何气体单质所含原子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com