
【题目】X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是
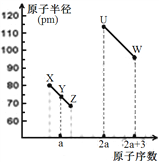
A. U、X、W 三种元素最高价氧化物对应的水化物酸性依次增强
B. 由Y、Z和氢三种元素形成的化合物中一定只含共价键
C. XZ2与X60的化学键类型和晶体类型都相同
D. X的位置是第2周期、第ⅣA族
【答案】B
【解析】化合物XZ是水煤气的主要成分之一,则XZ为CO,根据原子半径X大于Z可知,X为C、Z为O,结合原子序数大小可知Y为N元素,则a=7;U的原子序数=2a=14,则U为Si元素;W的原子序数=2a+3=17,为Cl元素。
A.U、X、W分别为Si、C、Cl,非金属性Cl>C>Si,则Si、C、Cl三种元素最高价氧化物的水化物酸性依次增强,故A正确;B、Y、Z分别为N、O,N、O、H可以形成离子化合物硝酸铵,硝酸铵中含有离子键和共价键,故B错误;C、XZ2、YZ2分别为CO2、NO2,X60为C60,前二者是极性共价键,C60中非极性共价键,三者都只含有共价键,形成的晶体都是分子晶体,故C正确;D、X是C元素,位置是第2周期、第ⅣA族,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣889.6kJ/mol.
(1)反应物能量总和_____(填“大于”、“小于”或“等于”)生成物能量总和.
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量_____889.6kJ.(填“>”、“<”或“=”)
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是_____.
(4)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.
①已知甲烷燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,通入甲烷的这个电极是_____(填“正极”或“负极”),其另外一电极上的电极反应式为:__________________.
②通常情况下,甲烷燃料电池的能量利用率_____(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是4种前三周期元素,且原子序数逐渐增大,这四种元素的基态原子的未成对电子数和电子层数相等。请回答下列问题:
(1)D元素的基态原子价电子排布式是:____________________________________;
(2)A、B、C三种元素可以形成化合物A4B2C2,它是厨房调味品之一。1 mol A4B2C2中含有________molσ键,其中B原子采用的杂化方式为:_____________;
(3)元素F的原子序数是介于B和C之间的,元素B、C、F的电负性的大小顺序是: _______________B、C、F的第一电离能的大小顺序是____________(由大到小,用元素符号填空);
(4)随着科学的发展和大型实验装置(如同步辐射和中子源)的建成,高压技术在物质研究中发挥越来越重要的作用。高压不仅会引发物质的相变,也会导致新类型化学键的形成。近年来就有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl 晶体在50~300GPa 的高压下和Na 或Cl2反应,可以形成不同组成、不同结构的晶体。下图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子)。写出A、B、C 的化学式。A:_______________; B:__________________; C:___________________

(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。合成磷化硼的化学反应方程式:BBr3+PBr3+3H2=BP+6HBr
①分别画出三溴化硼分子和三溴化磷分子的结构。_____________、_________________

磷化硼晶体中磷原子作面心立方最密堆积,硼原子填入部分四面体空隙中。磷化硼的晶胞示意图如下:

②已知磷化硼的晶胞参数a = 478 pm,计算晶体中硼原子和磷原子的核间距(dB-P)(写出计算式,不要求计算结果)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2×10-3mol的KZO4恰好将30mL0.1mol/L的Na2SO3溶液氧化为Na2SO4,则元素Z在还原产物中的化合价是
A.+2B.+3C.+4D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. ①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式: . 
②已知:
化学键 | H﹣H | N≡N |
键能(kJ/mol) | 435 | 943 |
试根据上表及图1中的数据计算N﹣H键的键能为kJ/mol.
③若起始时向容器内放入1mol N2和3mol H2 , 10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知: CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=﹣53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)CH3OCH3 (g)+3H2O(g)△H3=kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是

A.电池A极区的电极反应式为:H2O2+2e-=2OH-
B.电池放电过程中,Na+从负极区向正极区移动
C.每有1mol NaBH4参加反应转移电子数为4NA
D.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2。按如下流程可制得Cu3N和铁红。
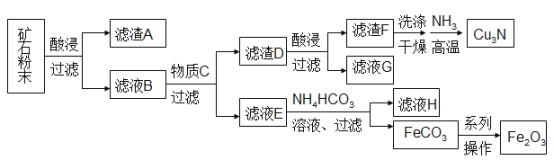
下列说法不正确的是
A. 每生成1mol Cu3N,转移的电子为6mol
B. 滤液G可以并入滤液E加以利用
C. 加入NH4HCO3溶液需控制温度以抑制Fe2+水解和NH4HCO3分解
D. 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日,最新发现的第113号、115号、117号和118号元素终于有了中文名称

根据元素周期律知识,下列预测或说法肯定不合理的是( )
A. Nh的最高价氧化物对应的水化物的化学式为H3NhO3是一种强酸
B. Mc的最高价阳离子为Mc5+,氧化性比较弱
C. Og是第七周期中的最后一种元素,其原子序数是所有已发现元素中最大的
D. 根据金属和非金属的分界线,Ts的中文名称为“钿”可能更合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,适宜用的试剂是( )
A. NaOH溶液 B. Ba(OH)2溶液 C. 盐酸 D. 氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com