
【题目】某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2。按如下流程可制得Cu3N和铁红。
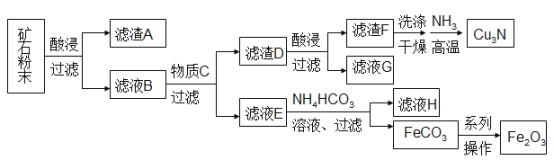
下列说法不正确的是
A. 每生成1mol Cu3N,转移的电子为6mol
B. 滤液G可以并入滤液E加以利用
C. 加入NH4HCO3溶液需控制温度以抑制Fe2+水解和NH4HCO3分解
D. 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧
【答案】A
【解析】试题分析:某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2,与酸反应,SiO2不反应,过滤滤渣A为是SiO2,滤液B中含有Cu2+、Fe2+、Fe3+,加C过滤,滤渣D最终转化为Cu3N,滤液最终转化为氧化铁,所以滤液E中含有Fe2+,滤渣D为Cu和多余的Fe,C为铁粉,滤渣D加酸溶解,过滤,滤液G为Fe2+溶液,滤渣F为Cu;滤液E中含有Fe2+与碳酸氢铵反应生成FeCO3,FeCO3在空气中煅烧得到Fe2O3。A.Cu转化为 Cu3N,Cu的化合价升高1价,则每生成1mol Cu3N,转移的电子为3mol,故A错误;B.由分析可知,滤液G为Fe2+溶液,滤液E中含有Fe2+,所以滤液G可以并入滤液E加以利用,故B正确;C.温度太高,会促进亚铁离子水解,而且NH4HCO3分解,所以需控制温度以抑制Fe2+水解和NH4HCO3分解,故C正确;D.通过过滤把FeCO3从溶液中分离出来,需要洗涤、干燥,然后在空气中煅烧就得到Fe2O3,故D正确;故选A。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应说法正确的是
A.氧化剂得电子越多说明氧化性越强B.氧化剂价态越高说明氧化性越强
C.Cu2+→ Cu的变化过程是还原反应D.氧化还原反应本质是元素化合价的升降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 . 在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是
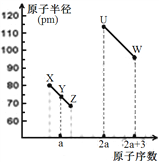
A. U、X、W 三种元素最高价氧化物对应的水化物酸性依次增强
B. 由Y、Z和氢三种元素形成的化合物中一定只含共价键
C. XZ2与X60的化学键类型和晶体类型都相同
D. X的位置是第2周期、第ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是

A. 原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B. 原溶液一定存在Cl-,可能存在Na+
C. 原溶液中c(CO32-) 是0.1mol·L-1
D. 若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应中的能量变化,表述正确的是( )
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.酸碱中和反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备实验流程如下:

已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
温度(℃) | 0 | 20 | 47 |
溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是__
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:____________
(3)实验操作1为 _________[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是_____
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH![]() Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。

已知: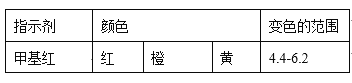
①当滴定到终点时,共需消耗NaOH溶液___mL(准确到0.01mL)。
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将______(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应:mX(g)+nY(g)pZ(g)+qQ(g),式中m、n、p、q为化学计量数.在0~3min内,各物质的量的变化如表所示:
物质 | X | Y | Z | Q |
时间 | ||||
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min内v(Q)=0.075molL﹣1min﹣1 , v(Z):v(Y)=1:2.
(1)2min内Z的反应速率v(Z)= .
(2)试确定以下物质的相关量:起始时n(Y)= , n(Q)= .
(3)方程式中m= , n= , p= , q= .
(4)对于该反应,能增大正反应速率的措施是 A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com