
(14分)煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:

①C(s) + H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) === CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min) 浓度(mol·L-1 ) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20min内,N2的平均反应速率v(N2)= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为 。
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①乙中A极产生的气体在标准状况下的体积为________________。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
(1)C(s) + 2H2O(g) = CO2(g) + 2H2(g) ⊿H= + 90.0 kJ·mol-1 高温
(2)①0.00015 mol/(L·S)或0.009 mol /(L·min) ②AD
(3)75%
(4)① 2.24L ②Cu2+ 280
【解析】
试题分析:(1)根据盖斯定律,①-②得C(s)+ 2H2O(g) = CO2(g) + 2H2(g) ⊿H= + 90.0 kJ·mol-1,该反应是熵增的吸热反应,根据△H-T△S<0可判断在高温下有利于正向自发进行。
(2)①根据图表信息,10~20min内,生成氮气0.25-0.16=0.09mol/L, N2的平均反应速率v(N2)=0.09mol/L÷10min=0.009 mol /(L·min),②30 min后,只改变某一条件,反应重新达到平衡,各物质的浓度等量的增大,但没有改变平衡,由于该反应是气体体积不变的化学反应,所以是改变压强所致,所以改变的条件可能是A.通入一定量的NO或D.适当缩小容器的体积,B.活性炭是固体,加入一定量的活性炭,不影响化学反应速率,也不影响平衡,C.加入合适的催化剂只能加快化学反应速率,不能改变平衡,也不会影响体积,选AD。
(3) CO(g) + H2O(g)  H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度0.020 0.020 0 0
变化浓度 n n n n
平衡浓度0.020-n 0.020-n n n
(n×n)÷(0.020-n )( 0.020-n ) =K=9 解得n=0.015
在该条件下达到平衡时,CO的转化率为(0.015/0.020)×100%=75%
(4)①用CO做燃料电池电解CuSO4溶液,CO作负极,氧气作正极,则A是阳极,B是阴极,设阳极生成气体x mol,电极反应为,阳极:4OH--4e-=2H2O+O2↑、阴极:Cu2++2e-=Cu 2H++2e-=H2↑
4x x 0.1 0.2 2x x
2x+0.2=4x x=0.1 则乙中A极产生的气体在标准状况下的体积为2.24L。
②参照图像中与电子的关系,可以发现图中③线表示的是Cu2+的变化,参照图像中与电子的关系,②线与电子关系是1:1,可以推出是Fe2+,当反应结束后,溶液中阳离子有Cu2+ 0.2mol, Fe2+ 0.5mol,要使金属阳离子恰好完全沉淀,共需要OH- 1.4mol,溶液体积为1.4/5=0.28L=280mL。
考点:考查热化学方程式的书写,化学反应速率的计算,电解的应用等知识。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(15分)原子序数小于36的X、Y、Z、W四种元素,其中X形成的单质是最轻的物质,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)X元素的元素符号是 ;W元素的元素名称是 。
(2)Y2X2分子中Y原子轨道的杂化类型为 ,(请选“sp”或“sp3”)1mol Y2X2含有σ键的数目为 。
(3)化合物ZX3的沸点比化合物YX4的高,其主要原因是________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
Ⅰ.(5分)15克有机物A完全燃烧只生成22克CO2和9克H2O。试求:
(1)该有机物的最简式 。
(2)符合该最简式的A物质有多种,则它们之间的关系 (填序号)
A、一定互为同系物
B、一定互为同分异构体
C、等质量的它们完全燃烧耗氧量相同
D、等物质的量的它们完全燃烧耗氧量相同
(3)若A的相对质量为90,且两分子A能反应形成六元环状酯,则A的结构简式为 。
Ⅱ.PTT优异性能,能作为纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:

其中A、B、C均为链状化合物,A能发生银镜反应,C不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,
C的名称(系统命名) 。
(2)由物质C与D反应生成PTT的化学方程式为 。
(3)请写出以有机物甲为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件)。
已知:
(合成路线常用的表示方式为:M N……
N…… 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
(14分)偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 ( L )+2N2O4 (L )=2CO2 (g)+3N2(g)+4H2O(g) (Ⅰ)
(1)该反应(Ⅰ)中还原剂是__________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
一定温度下,反应(Ⅱ)的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________.

若在相同温度下,上述反应改在体积为3L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应4s后N2O4的物质的量为0.9mol,则0~4s内的平均反应速率v(NO2)=_________________。
(3)25℃时,将1mol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将_______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为____mol·L-1。(NH3·H2O的电离平衡常数K=2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
化学与社会、生产、生活紧切相关。下列说法正确的是
A.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
B.石油干馏可得到石油气、汽油、煤油、柴油等
C.从海水中提取物质都必须通过化学反应才能实现
D.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:选择题
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是

A.通入N2的电极发生的电极反应式为:N2 + 6e- + 8H+== 2NH4+
B.反应过程中溶液的pH会变大,故需要加入盐酸
C.该电池外电路电流从通入H2的电极流向通入N2的电极
D.通入H2的电极为负极,A为NH4Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:填空题
(15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下:
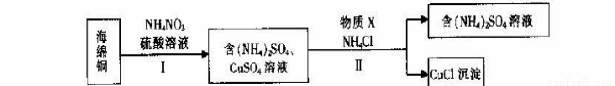
①步骤I中,反应温度不宜过高的原因是 。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为 。
③步骤II中,物质X可选用的物质是 。(填序号)。
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是 _。
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s) 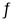 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q)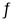 CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
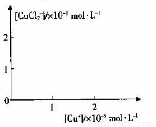
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月教学质量检查理综化学试卷(解析版) 题型:选择题
常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列
有关叙述正确的是
A.加入适量的NaCl,可使c(NH4+) = c(Cl-)
B.滴加几滴浓氨水,c(NH4+)减小
C.滴加几滴浓盐酸, 的值减小
的值减小
D.1.0 mol·L-1的NH4Cl溶液中c(NH4+)比该混合溶液大
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市等三校高二上学期期末化学试卷(解析版) 题型:选择题
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:

 , 下列说法不正确的是
, 下列说法不正确的是
A.恒温下向溶液中加CaO,溶液的pH不变
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量不变
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com