
(15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下:
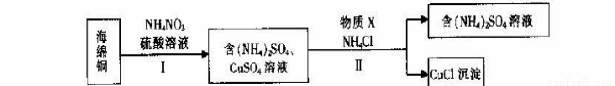
①步骤I中,反应温度不宜过高的原因是 。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为 。
③步骤II中,物质X可选用的物质是 。(填序号)。
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是 _。
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s) 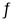 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q)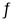 CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
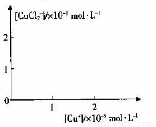
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
(1)还原剂 (2)H2O2+2e-+2H+=2H2O
(3)①防止产生氮氧化物造成污染
②4Cu+NO3-+10H+=4Cu2++NH4+ +3H2O ③ad ④防止CuCl被氧化
⑤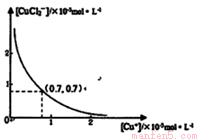
【解析】
试题分析:(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,铜元素由+2价得电子生成+1价的Cu2O,作氧化剂,该反应中葡萄糖是还原剂。
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4,若将该反应设计成原电池,铜失电子做负极,正极是H2O2 得电子生成水,则正极的电极反应式为H2O2+2e-+2H+=2H2O。
(3)①硝酸铵受热分解生成氮氧化物,所以步骤I中,反应温度不宜过高的原因是防止产生氮氧化物造成污染,②用NH4NO3氧化海绵铜,铜失电子,NO3-得电子,0.5 mol NH4NO3参加反应有4mol电子转移,说明1molNO3-得8mol电子,氮元素由+5价降低到—3价,所以铜参与反应的离子方程式为4Cu+NO3-+10H+=4Cu2++NH4+ +3H2O,③步骤II是将硫酸铜还原成CuCl,铜元素由+2价降低到+1价,做氧化剂,需加入具有还原性的物质,且不引入杂质,a. Cu 和d. (NH4)2SO3具有还原性,能达到要求,b. C12 和c. H2O2 都具有强氧化性,不符,所以物质X可选用的物质是ad,④CuCl很不稳定,容易被氧化,步骤II中物质X需要过量的原因,其一是加快反应速率,其二是防止CuCl被氧化,
⑤根据①Cu Cl(s) 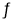 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6, ② Cu Cl(s) + Cl一(a q)
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6, ② Cu Cl(s) + Cl一(a q)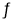 [CuCl2]-1(a q) K=0.35 ,①+②得2Cu Cl(s)
[CuCl2]-1(a q) K=0.35 ,①+②得2Cu Cl(s) 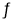 Cu+(a q)+ [CuCl2]- (a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)= 0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:
Cu+(a q)+ [CuCl2]- (a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)= 0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:

考点:考查葡萄糖的化学性质,用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的工艺流程,化学图像的绘制。


科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>碳化硅 B.K>Na
C.HCHO<CH3OH D.NaF<NaCl<NaBr
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
同分异构体数目与C6H14相同的化合物是
A.C4H8 B.C4H9Cl C.C4H10O D.C4H8O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:填空题
(14分)煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:

①C(s) + H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) === CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min) 浓度(mol·L-1 ) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20min内,N2的平均反应速率v(N2)= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为 。
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①乙中A极产生的气体在标准状况下的体积为________________。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:选择题
下列有关物质制取或性质探究实验设计不能达到实验目的的是

A.利用图1制取并收集干燥的氨气
B.利用图2制取Fe(OH)2,使用煤油的目的是防止生成的Fe(OH)2被空气氧化
C.利用图3制取并收集NO2气体
D.利用图4用酒精制取无水乙醇
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:选择题
甲、乙、丙是中学化学常见物质,一定条件下能发生转化:甲+强酸→乙十丙十H2O ,其中乙为盐,丙为气体。下列说法正确的是
A.甲一定是金属单质 B.甲与乙一定含有同种元素
C.丙一定是氧化物 D.该反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月教学质量检查理综化学试卷(解析版) 题型:填空题
(16分)
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。
方法一 铜粉还原CuSO4溶液

已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl-  [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)将废铜板浸入热的H2SO4溶液中,并通入空气,可以生成CuSO4。该反应的离子方程式为 。
(2)①中,“加热”的目的是 ,当观察到 现象,即表明反应已经完全。
(3)②中,加入大量水的作用是 。
(4)潮湿的CuCl在空气中易发生水解和氧化。上述流程中,为防止水解和氧化所添加的试剂或采取的操作是 。
方法二 铜电极电解饱和食盐水(实验装置如图)

(5)阳极的电极反应式为 。
(6)实验开始时,阳极附近没有产生CuOH沉淀的原因是 。(已知:Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市高三教学质量检查理综化学试卷 (解析版) 题型:选择题
在溶液中能大量共存的一组离子或分子是
A.NH4+、H+、NO3-、HCO3-
B.K+、Al(OH)4-、SO42-、NH3·H2O
C.Na+、K+、SO32-、ClO-
D.Na+、CH3COO-、SO42-、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com