
同分异构体数目与C6H14相同的化合物是
A.C4H8 B.C4H9Cl C.C4H10O D.C4H8O2
A
【解析】
试题分析:C6H14是己烷有5种同分异构体。A、C4H8属于烯烃的同分异构体有3种:1-丁烯、2-丁烯、2-甲基丙烯,属于属于环状的同分异构体有2种:环丁烷、甲基环丙烷,所以共5种同分异构体,正确;B、有正丁烷和异丁烷两种同分异构体,被Cl取代的产物氯丁烷有4种,所以C4H9Cl有4种同分异构体,错误;C、C4H10O属于饱和一元醇,与B相似,羟基取代丁烷中的H原子,所以也有4种同分异构体,错误;D、C4H8O2的同分异构体可以是羧酸或酯类,属于羧酸类的同分异构体有2种:正丁酸和异丁酸,属于酯类的同分异构体有:甲酸正丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯,所以共6种同分异构体,错误,答案选A。
考点:考查同分异构体的判断


科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:选择题
X、Y、Z、M、N代表五种金属,有以下化学反应:
①水溶液中:X+Y2+===X2++Y;
②Z+2H2O(冷)===Z(OH)2+H2↑;
③M、N为电极与N盐溶液组成原电池,负极反应为:M-2e-=M2+;
④Y可以溶于稀H2SO4中,M不能被H2SO4氧化。
则这五种金属的活动性由弱到强的顺序是
A.M<N<Y<X<Z B.N<M<Y<X<Z
C.N<M<X<Y<Z D.X<Z<N<M<Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:选择题
常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是

A.H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8
B.Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性
C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右
D. pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
Ⅰ.(5分)15克有机物A完全燃烧只生成22克CO2和9克H2O。试求:
(1)该有机物的最简式 。
(2)符合该最简式的A物质有多种,则它们之间的关系 (填序号)
A、一定互为同系物
B、一定互为同分异构体
C、等质量的它们完全燃烧耗氧量相同
D、等物质的量的它们完全燃烧耗氧量相同
(3)若A的相对质量为90,且两分子A能反应形成六元环状酯,则A的结构简式为 。
Ⅱ.PTT优异性能,能作为纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:

其中A、B、C均为链状化合物,A能发生银镜反应,C不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A的结构简式为 ,
C的名称(系统命名) 。
(2)由物质C与D反应生成PTT的化学方程式为 。
(3)请写出以有机物甲为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件)。
已知:
(合成路线常用的表示方式为:M N……
N…… 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
已知四种盐的溶解度(S)曲线如下图所示,下列说法不正确的是
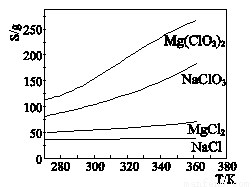
A.将NaClO3溶液蒸干灼烧可得NaCl固体
B.将Mg(ClO3)2溶液蒸干灼烧可得MgCl2固体
C.一定条件下MgCl2和NaClO3可发生复分解反应生成Mg(ClO3)2
D.NaClO3中混有少量MgCl2杂质,可用重结晶法提纯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
(14分)偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 ( L )+2N2O4 (L )=2CO2 (g)+3N2(g)+4H2O(g) (Ⅰ)
(1)该反应(Ⅰ)中还原剂是__________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
一定温度下,反应(Ⅱ)的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________.

若在相同温度下,上述反应改在体积为3L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应4s后N2O4的物质的量为0.9mol,则0~4s内的平均反应速率v(NO2)=_________________。
(3)25℃时,将1mol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将_______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为____mol·L-1。(NH3·H2O的电离平衡常数K=2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
化学与社会、生产、生活紧切相关。下列说法正确的是
A.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
B.石油干馏可得到石油气、汽油、煤油、柴油等
C.从海水中提取物质都必须通过化学反应才能实现
D.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:填空题
(15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下:
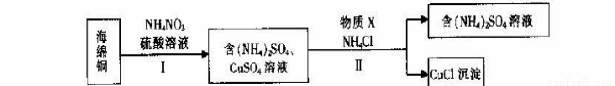
①步骤I中,反应温度不宜过高的原因是 。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为 。
③步骤II中,物质X可选用的物质是 。(填序号)。
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是 _。
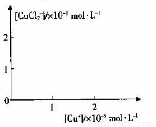
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s) 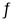 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q)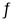 CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省深圳市南山区上学期高一化学期末试卷(解析版) 题型:选择题
同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是
A.体积比为11︰16 B.密度比为11︰16
C.氧原子数比为1︰1 D.物质的量比为16︰11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com