
已知四种盐的溶解度(S)曲线如下图所示,下列说法不正确的是
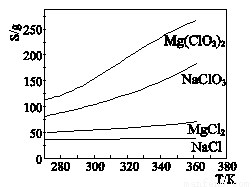
A.将NaClO3溶液蒸干灼烧可得NaCl固体
B.将Mg(ClO3)2溶液蒸干灼烧可得MgCl2固体
C.一定条件下MgCl2和NaClO3可发生复分解反应生成Mg(ClO3)2
D.NaClO3中混有少量MgCl2杂质,可用重结晶法提纯
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:实验题
(8分)草酸晶体的组成可表示为:H2C2O4·XH2O,为测定X值,进行下列实验:
①称取wg草酸晶体配成100.0mL水溶液;
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为cmol·L-1KMnO4溶定。滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为配制准确浓度的草酸溶液,所需用到的仪器是:天平(含砝码)、烧杯、药匙和__________。
(2)实验②中,滴定时,KMnO4溶液应装在 (填“酸式滴定管”、“碱式滴定管”或“移液管”中,原因是_____________________。
(3)判断滴定结束的标准是 __________________________________________ 。
(4)若滴定时,反应前后的两次读数分别为a和b,由此计算出草酸晶体的X值是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:实验题
(16分)铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O↓…………(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O …………(b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2O
Ⅱ.ZnSO4·7H2O
Ⅲ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到
75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。

实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入 。
A.纯锌粉 B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:选择题
某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4  LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A.锂离子电池放电时Li+向正极迁移
B.镍氢电池放电时,正极的电极反应式:NiOOH+H2O +e-== Ni(OH)2+OH-
C.上图表示用锂离子电池给镍氢电池充电
D.锂离子电池充电时,阴极的电极反应式:LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:实验题
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
Sn2++4Cl-+2HgCl2=== SnCl +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.3 | 7.5 | 3.4 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 9.7 | 4.4 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:__________________________;
b.沉淀:_____________________;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
同分异构体数目与C6H14相同的化合物是
A.C4H8 B.C4H9Cl C.C4H10O D.C4H8O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2可使酸性高锰酸钾褪色 | SO2有漂白性 |
B | 浓硫酸具有脱水性和强氧化性 | 浓硫酸滴到湿润的蔗糖中,蔗糖变 成黑色海绵状 |
C | SiO2有导电性 | SiO2可用于制备光导纤维 |
D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | Ksp(BaSO4)<Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:选择题
下列有关物质制取或性质探究实验设计不能达到实验目的的是

A.利用图1制取并收集干燥的氨气
B.利用图2制取Fe(OH)2,使用煤油的目的是防止生成的Fe(OH)2被空气氧化
C.利用图3制取并收集NO2气体
D.利用图4用酒精制取无水乙醇
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省深圳市南山区上学期高一化学期末试卷(解析版) 题型:填空题
(14分)
I.(6分)下表是生活生产中常见的物质,表中列出了它们一种主要成分(其它成分未列出)
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 绿矾 | 醋精 | 苏打 | 酒精 | 铜导线 | 蔗糖 | 烧碱 |
主要 成分 | FeSO4 | CH3COOH | Na2CO3 | CH3CH2OH | Cu | C12H22O | NaOH |
(1)请你对表中①~⑦的主要成分进行分类(填编号)
属于电解质的是 ,属于非电解质的是 。
(2)写出②与⑦反应的离子方程式
Ⅱ.(8分)5molCO的质量为 ,其中含有 个一氧化碳分子。(用NA表示)相同质量的H2、NO、 O2、Cl2四种气体中,含有分子数目最少的是 ,在相同温同压下,体积最大的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com