
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
Sn2++4Cl-+2HgCl2=== SnCl +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.3 | 7.5 | 3.4 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 9.7 | 4.4 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:__________________________;
b.沉淀:_____________________;
c.分离,洗涤;
d.烘干,研磨。
(15分).
(1)抑制Fe3+的水解(2分)
(2)14 Fe3++FeS2+8H2O=15 Fe2++2SO42-+16H+ (2分)
(3)①偏低(1分),
②若不加HgCl2,溶液中含有Sn2+,也可以被K2Cr2O7标准溶液氧化,消耗K2Cr2O7标准溶液的体积偏多,则测定的Fe3+量偏高(2分)
(4)①KSCN(2分);4Fe2++O2+4H+=4Fe3++H2O(2分)
②a 向溶液中加入过量的酸性高锰酸钾溶液,搅拌(2分)
b滴加NaOH溶液,调节溶液的pH为3.2~3.4(2分)
【解析】
试题分析:(1)因为Fe2O3、SiO2、Al2O3、MgO等杂质溶于硫酸后生成相应的金属离子,都会发生水解反应,该实验的目的之制备氧化铁,所以加入硫酸过量的主要目的是抑制Fe3+的水解;
(2)加入FeS2后将铁离子还原为亚铁离子,同时FeS2被氧化为SO,则根据元素守恒,则该反应中有水参加,产物中有氢离子生成,所以离子方程式是14 Fe3++FeS2+8H2O=15 Fe2++2SO42-+16H+;
(3)①若SnCl2不足量,则铁离子不能全部被还原,则消耗的K2Cr2O7标准溶液的体积偏少,造成测定的Fe3+量偏低;
②若不加HgCl2,则多余的SnCl2也会被K2Cr2O7标准溶液氧化,消耗K2Cr2O7标准溶液的体积偏多,测定结果偏高;
(4)①可选用KSCN溶液检验滤液中的铁离子,去少量的滤液,加入KSCN溶液后,滤液变红色,证明含有铁离子;在过滤的过程中,亚铁离子可能被空气中的氧气氧化为铁离子,离子方程式是4Fe2++O2+4H+=4Fe3++H2O;
②a 、过滤后的滤液中,含有少量铁离子、亚铁离子、铝离子、镁离子,该实验的目的是制备氧化铁,所以先将亚铁离子氧化为铁离子,则向溶液中加入过量的酸性高锰酸钾溶液,搅拌,不能选择稀硝酸,因为亚铁离子与稀硝酸反应产生有毒气体NO;
b、调节溶液的pH,因为只需将铁离子完全沉淀即可,根据表中数据可知,调节溶液的pH在3.2~3.4之间,则只有铁离子沉淀,所以沉淀步骤的操作是滴加NaOH溶液,调节溶液的pH为3.2~3.4。
考点:考查对工艺流程的分析,离子的检验,离子方程式的书写,实验方案的设计


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
下列关于化学反应类型的叙述中,正确的是
A.凡是生成盐和水的反应都是中和反应
B.两种酸之间一定不能发生反应
C.生成一种单质和一种化合物的反应一定是置换反应
D.复分解反应一定没有单质参加
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:填空题
(16分)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9KJ·g-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)  CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。

(2)改变温度,使反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:选择题
X、Y、Z、M、W五种短周期元素。X的质子总数与电子层数相同,Y、Z、M、W在周期表中的相对位置如下表,且W原子核外电子数是M原子最外层电子数的2倍。下列说法不正确的是
Y | Z | M | |
W |
A.原子半径:W>Y>Z>M>X
B.X、Y、Z 三种元素形成的化合物中可能既有离子键又有共价键
C.W分别与M、Z元素形成的化合物WM4、WZ2都是原子晶体
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
已知四种盐的溶解度(S)曲线如下图所示,下列说法不正确的是
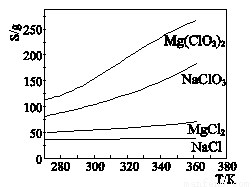
A.将NaClO3溶液蒸干灼烧可得NaCl固体
B.将Mg(ClO3)2溶液蒸干灼烧可得MgCl2固体
C.一定条件下MgCl2和NaClO3可发生复分解反应生成Mg(ClO3)2
D.NaClO3中混有少量MgCl2杂质,可用重结晶法提纯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:实验题
(15分)TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)==TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下

有关性质如下表
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通入氮气;反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解TiOSO4(aq)+ 2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:选择题
根据下列各图曲线表征的信息,得出的结论不正确的是

A.图1表示常温下向体积为10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C.图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市高三教学质量检查理综化学试卷 (解析版) 题型:选择题
下列说法正确的是
A.乙烯和甲烷都能发生加成反应 B.CuSO4溶液能使鸡蛋清盐析而沉淀
C.米酒变酸是因为乙醇被氧化为乙酸 D.HNO3不能与苯发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com