
X、Y、Z、M、W五种短周期元素。X的质子总数与电子层数相同,Y、Z、M、W在周期表中的相对位置如下表,且W原子核外电子数是M原子最外层电子数的2倍。下列说法不正确的是
Y | Z | M | |
W |
A.原子半径:W>Y>Z>M>X
B.X、Y、Z 三种元素形成的化合物中可能既有离子键又有共价键
C.W分别与M、Z元素形成的化合物WM4、WZ2都是原子晶体
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
C
【解析】
试题分析:根据Y、Z、M、W在周期表中的相对位置,则X是第一周期元素H元素;W原子核外电子数是M原子最外层电子数的2倍,则W的原子序数是偶数,因为M的最外层电子数不可能大于7,则W的原子序数小于或等于14,同时W是第三周期元素,原子序数大于10,所以W只能是14号元素
Si,则Y是N、Z是O、M是F元素。A、根据以上分析,五种元素的原子半径的大小关系是W>Y>Z>M>X,正确;B、H与N、O三种元素形成的化合物可能是硝酸铵,既有离子键也有共价键,正确;C、Si与F、O形成的化合物中,只有二氧化硅是原子晶体,而SiF4属于分子晶体,错误;D、五种元素中,F的非金属性最强,所以形成的氢化物中稳定性最好;水和HF都是分子晶体,相对分子质量越大,沸点越高,正确,答案选C。
考点:考查元素的推断,元素化合物性质的应用


科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞变红的溶液:Na+ Cl- SO42- AlO2-
B.某无色溶液:CO32- NO3- Al3+ Ba2+
C.加入Al能放出H2的溶液中 NH4+、Cl-、Na+、SO42-
D.酸性溶液中: NO3-、SO32-、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分子晶体的熔点比金属晶体的低
B.在晶体中只要有阳离子,一定有阴离子
C.在SiO2晶体中,Si原子与Si—O键数目比为1:2
D.离子化合物中可能含有非极性共价键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.淀粉、纤维素和油脂都属于天然高分子化合物
B.蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解
C.等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少
D.分子式为C2H4O2与C4H8O2的两种物质一定属于同系物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:推断题
(10分)某科研小组利用石油分馏产品经下列路线,合成一种新型香料。

已知X分子中碳氢质量比为24∶5,A、E都是X的裂解产物,且二者互为同系物,D与饱和NaHCO3溶液反应产生气体。
信息提示:卤代烃在强碱水溶液中发生水解(取代)反应生成醇。如:

(1)X分子为直链结构,X的名称为 ;C中官能团的名称为 。
(2)①~⑥的反应中,下列反应类型存在且数目由多到少的是 。(用字母和“>”写出)
A.加成反应 B.加聚反应 C.取代反应 D.氧化反应
(3)B与D在浓硫酸作用下,生成甲,则与甲同类别的同分异构体的有 种(不包括甲)
(4)写出⑥的化学反应方程式 。
(5)E可能发生下列选项中的某种反应,写出能反应的化学方程式 。
A.皂化反应 B.与乙酸的酯化反应
C.加聚反应 D.与银氨溶液的银镜反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:实验题
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
Sn2++4Cl-+2HgCl2=== SnCl +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.3 | 7.5 | 3.4 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 9.7 | 4.4 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:__________________________;
b.沉淀:_____________________;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,X元素的气态氢化物与其最高级氧化物对应的水化物能反应生成一种盐,Y原子的最外层电子数与其电子层数相等,Z、W与Y同周期且互不相邻。下列叙述正确的是
A.X的单质与氧气反应可生成六种氧化物
B.Z位于第3周期第ⅥA族
C.对应单质熔点:Z >Y > W
D.对应原子半径:Z > W > X
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质](15分)
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子。
(1)写出基态E原子的价电子排布式 。
(2)B、C、D三种元素第一电离能由小到大的顺序为 (用元素符号表示)。
(3)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式 。
(4)A2D的沸点在同族元素中最高,其原因是 。A2D由液态形成晶体时密度 (填“增大”、“不变”或“减小”),其主要原因 (用文字叙述)。
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为 (用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g·cm-3(用含a、NA的符号表示)。
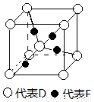
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市高三教学质量检查理综化学试卷 (解析版) 题型:选择题
已知:NH2COO-+2H2O  HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是
HCO3-+NH3·H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示。以下分析正确的是

A.无法判断T1和T2的大小关系
B.T1 ℃时,第6min反应物转化率为6.25%
C.T2 ℃时,0~6min ν(NH2COO-)=0.3mol·L-1·min-1
D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com