
下列说法正确的是
A.分子晶体的熔点比金属晶体的低
B.在晶体中只要有阳离子,一定有阴离子
C.在SiO2晶体中,Si原子与Si—O键数目比为1:2
D.离子化合物中可能含有非极性共价键
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:2014-2015山东省德州市高二2月期末统考化学试卷(解析版) 题型:填空题
(12分)甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:

(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是_____。
a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.增大体系压强
d.使用高效催化剂
(2)已知:
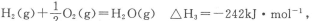
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________________.
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答:

①在图中三条曲线,对应的温度由高到低的顺序是__________________;
②利用a点对应的数据,计算出曲线Z在对应温度下 的平衡常数:K=______;
的平衡常数:K=______;
(4)恒温下,分别将1 molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应。
①达到平衡所需时间是I _____Ⅱ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中CH3OH的体积分数关系是I_____Ⅱ。
②平衡时,测得容器工中的压强减小了30%,则该容器中CO的转化率为______。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期末化学试卷(解析版) 题型:填空题
(14分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气: N2(g)+3H2(g)2NH3(g) △H<0,一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 ,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸:
①NH3被氧气催化氧化生成NO的反应的化学方程式是___________________________________;
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)2NO2(g)△H>0 该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)_______________;

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2(g)N2O4(g) △H<0,恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1、a2,已知T1<T2,则a1_______a2
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气:
①催化还原法:催化剂存在时用H2将NO2还原为N2;
已知:2H2(g)+O2(g)=2H2O(g) △H=﹣483.5kJ/mol 、N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是_________________________;
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2,若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
现在四种晶体,其离子排列方式如图所示,其中化学式正确的是
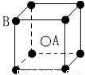



A.AB2 B.EF2 C.XY3Z D.AB3
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:填空题
(18分)
Ⅰ.(7分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为 ;
(2)NaH2PO2为 (填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 。
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4︰1,则该反应的氧化产物的化学式为 。
Ⅱ.(11分)某无机化合物A的相对分子质量为184。在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7。将18.4gA隔绝空气加强热可得到12.8g B和气体单质C。请回答下列问题:
(1)A的化学式为 ,C的电子式为 。
(2)写出SCl2与氨反应的化学方程式: 。
(3)亚硝酸钠和X固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(4)请设计检验物质X的实验方案: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:选择题
X、Y、Z、M、W五种短周期元素。X的质子总数与电子层数相同,Y、Z、M、W在周期表中的相对位置如下表,且W原子核外电子数是M原子最外层电子数的2倍。下列说法不正确的是
Y | Z | M | |
W |
A.原子半径:W>Y>Z>M>X
B.X、Y、Z 三种元素形成的化合物中可能既有离子键又有共价键
C.W分别与M、Z元素形成的化合物WM4、WZ2都是原子晶体
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:填空题
选考[化学—有机化学基础](13分)

(1)可鉴别风信子醛和突厥酮的试剂是 。
(2)下列关于风信子醛和突厥酮的说法中正确的是 (填序号)。
a.都属于芳香族化合物 b.都能使酸性高锰酸钾溶液褪色
c.突厥酮的分子式为C13H20O d风信子醛不能发生加成反应
(3)突厥酮与嗅水反应的化学方程式为 。
(4)芳香烃A发生如下反应生成F:

F与冬青油互为同分异构体。请回答:
①若A的分子式为C10 H14,则能实现上述转化的A的同分异构体有 种
②C→D的反应类型为 。
③设汁C→D和E→F步骤的目的为 。
④F生成高聚物的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com