
根据下列各图曲线表征的信息,得出的结论不正确的是

A.图1表示常温下向体积为10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C.图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
B
【解析】
试题分析:A.b点是等体积等浓度的NaOH和CH3COOH 恰好反应,生成醋酸钠,强碱弱酸盐,溶液显碱性,根据质子守恒可得:c(CH3COOH)+c(H+)=c(OH-),正确;B.PH值相同的盐酸和醋酸加水稀释,醋酸是弱酸,随着加水稀释,醋酸继续电离,PH值的变化较慢,所以Ⅰ表示盐酸,Ⅱ表示醋酸,错误;C.燃烧热是1mol,氢气完全燃烧生成液体水时放出的热量,由图可知,生成2mol水时放热571.6kJ,则H2的燃烧热为285.8 kJ·mol-1,正确;D.根据图像可知,Fe3+在4左右沉淀完全,但Cu2+还没有沉淀,所以若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右,正确;选B。
考点:考查化学图像分析,溶液中的平衡,弱电解质的电离及PH的计算,物质的除杂等知识。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(15分)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H)化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C | |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiCl4 SiO2;Si SiC
(2)下图每个“●”表示硅晶体中的一个硅原子,每个硅原子与Si—Si键数之比为_____________,属于_________晶体。

(3)工业上所用的高纯硅可以通过下列反应制备得到:SiCl4(g)+2H2(g) =Si(s)+4HCl(g);
根据此方程式并结合上述表格中数据可计算出此反应的△H=+236KJ.mol-1,请判断该反应是 反应(填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:实验题
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
Sn2++4Cl-+2HgCl2=== SnCl +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.3 | 7.5 | 3.4 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 9.7 | 4.4 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:__________________________;
b.沉淀:_____________________;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2可使酸性高锰酸钾褪色 | SO2有漂白性 |
B | 浓硫酸具有脱水性和强氧化性 | 浓硫酸滴到湿润的蔗糖中,蔗糖变 成黑色海绵状 |
C | SiO2有导电性 | SiO2可用于制备光导纤维 |
D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | Ksp(BaSO4)<Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质](15分)
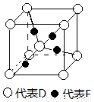
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子。
(1)写出基态E原子的价电子排布式 。
(2)B、C、D三种元素第一电离能由小到大的顺序为 (用元素符号表示)。
(3)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式 。
(4)A2D的沸点在同族元素中最高,其原因是 。A2D由液态形成晶体时密度 (填“增大”、“不变”或“减小”),其主要原因 (用文字叙述)。
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为 (用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g·cm-3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:选择题
下列有关物质制取或性质探究实验设计不能达到实验目的的是

A.利用图1制取并收集干燥的氨气
B.利用图2制取Fe(OH)2,使用煤油的目的是防止生成的Fe(OH)2被空气氧化
C.利用图3制取并收集NO2气体
D.利用图4用酒精制取无水乙醇
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:选择题
在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示下列说法错误的是

A.P1> P2> P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.若T1> T2> T3>T4,则该反应为放热反应
D.T4、P4、时,H2的平衡转化率为60%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月教学质量检查理综化学试卷(解析版) 题型:选择题
下列关于有机物的判断错误的是
A.乙烯和苯使溴水褪色的原理不同
B.乙醇、乙酸都能和金属钠反应
C.C2H6O只代表一种物质
D.淀粉和纤维素都可作为工业上生产葡萄糖的原料
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市等三校高二上学期期末化学试卷(解析版) 题型:选择题
下列水解的离子方程式正确的是
A.S2﹣+2H2O H2S+2OH﹣ B.Fe3++3H2O
H2S+2OH﹣ B.Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
C.HCO3﹣+H2O CO32﹣+H3O+ D.HS﹣+H2O
CO32﹣+H3O+ D.HS﹣+H2O H2S ↑ + OH﹣
H2S ↑ + OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com