
【题目】在相同温度时,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.与Mg反应的起始速率
C.OH﹣的物质的量浓度
D.溶液中 
【答案】C
【解析】解:相同温度时,醋酸的电离程度与酸浓度成反比, A.中和时所需NaOH的量与醋酸的物质的量成正比,n(CH3COOH)=0.01mol/L×0.1L=0.1mol/L×0.01L=0.001mol,两种酸的物质的量相等,则消耗的NaOH相等,故A错误;
B.反应速率与氢离子浓度成正比,前者醋酸电离程度大、后者醋酸电离程度小,则溶液中c(H+)前者大于后者,所以开始与镁反应速率:前者大于后者,故B错误;
C.醋酸溶液中c(OH﹣)与溶液中c(H+)成反比,溶液中c(H+)前者大于后者,所以c(OH﹣)前者小于后者,故C正确;
D.溶液中 ![]() =Ka,电离平衡常数只与温度有关,温度不变,离子积常数不变,故D错误;
=Ka,电离平衡常数只与温度有关,温度不变,离子积常数不变,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】(1)①Cu ②CO2 ③H2SO3④H2O⑤液态HCl ⑥H2SO4⑦Ba(OH)2 ⑧NaCl ⑨蔗糖 ⑩NaOH溶液
上述物质中属于电解质的是______________,属于非电解质的是________,能导电的是_________。 (填序号,必须填全,否则不得分)
(2)与16g氧气所含原子总数相同的氨气是_________________g。
(3)已知实验室制取氯气的反应原理为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比为________
②当2 mol MnO2参加反应时转移电子______mol
③当转移1 mol电子时能生成标准状况下的Cl2______L
④浓盐酸在反应中显示出来的性质是______(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用无水芒硝(Na2SO4)﹣炭粉还原法,其流程示意图如图1: 
(1)上述流程中“碱浸”后,物质A必须经过(填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2 , 写出煅烧时发生的总的化学反应方程式为 .
(2)上述流程中采用稀碱液比用热水更好,理由是 .
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌.若反应后测得溶液的pH=4,则此时溶液中c( S2﹣)= . (已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10﹣36、2.2×10﹣20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图2所示).为使除汞效果最佳,应控制的条件是、 . ②某毛纺厂废水中含0.001 molL﹣1的硫化钠,与纸张漂白后的废水(含0.002 molL﹣1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用右图所示装置进行NaHCO3的受热分解实验。请回答:

(1)加热一段时间后,烧杯中观察到的实验现象是__________________________
(2)实验结束时的正确操作是____(填字母);
A.先从液体中移出导管,再熄灭酒精灯
B.先熄灭酒精灯,再从液体中移出导管。
否则会引起___________。
(3)NaHCO3受热分解的化学方程式________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙酸和乙醇发生酯化反应的说法正确的是
A. 用CH3CH218OH与CH3COOH发生酯化反应,生成H218O
B. 浓硫酸的作用是中和碱性物质
C. 反应液混合时,顺序为先取乙醇再加入浓硫酸最后加入乙酸
D. 用蒸馏的方法从饱和Na2CO3溶液中分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料. ①Ti2+基态的外围电子排布式可表示为 .
②BH4﹣的空间构型是(用文字描述).
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 ![]() 2NH3实现储氢和输氢.下列说法正确的是(多项选择).
2NH3实现储氢和输氢.下列说法正确的是(多项选择).
A.NH3分子中N原子采用sp3杂化
B.相同压强时,NH3沸点比PH3高
C.[Cu(NH3)4]2+离子中,N原子是配位原子
D.CN﹣的电子式为[:C┇┇N:]﹣
(3)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子. ①C60晶体易溶于苯、CS2 , C60是分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ键数目为 .
(4)一种由Mg和H元素组成的物质是金属氢化物储氢材料,其晶胞结构如图2所示,该物质化学式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3溶于水含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+3B(g)M(g)+N(g);△H=﹣49.0kJmol﹣1 . 一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( ) 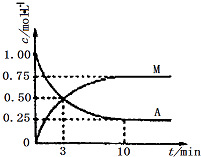
A.充分反应后该反应放出98 kJ的热量
B.10min后,升高温度能使 ![]() 增大
增大
C.3min时B的生成速率是M生成速率的3倍
D.反应到达平衡时刻B的转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.。已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为
A. C30H60B. C30H56C. C30H52D. C30H50
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com