
����Ŀ�����ܵĴ洢������Ӧ�õ���Ҫƿ����Ŀǰ�����û������о�����Ҫ��������У���λ�⻯��������廯���̼�ʲ��ϡ������⻯��ȣ�
��1��Ti��BH4��2��һ�ֹ���Ԫ�����⻯�ﴢ����ϣ� ��Ti2+��̬����Χ�����Ų�ʽ�ɱ�ʾΪ ��
��BH4���Ŀռ乹��������������������
��2��Һ���Ǹ������ʣ������ܵ��������壬����N2+3H2 ![]() 2NH3ʵ�ִ�������⣮����˵����ȷ����������ѡ��
2NH3ʵ�ִ�������⣮����˵����ȷ����������ѡ��
A.NH3������Nԭ�Ӳ���sp3�ӻ�
B.��ͬѹǿʱ��NH3�е��PH3��
C.[Cu��NH3��4]2+�����У�Nԭ������λԭ��
D.CN���ĵ���ʽΪ[��C����N��]��
��3��2008�꣬Yoon���˷���Ca��C60�����ӽṹ��ͼ1�����ɵ�Ca32C60�ܴ�������H2���ӣ� ��C60���������ڱ���CS2 �� C60�����ӣ�����ԡ��Ǽ��ԡ�����
��1mol C60�����У����ЦҼ���ĿΪ ��
��4��һ����Mg��HԪ����ɵ������ǽ����⻯�ﴢ����ϣ��侧���ṹ��ͼ2��ʾ�������ʻ�ѧʽΪ �� 
���𰸡�
��1��3d2����������
��2��ABCD
��3���Ǽ��ԣ�90NA
��4��MgH2
���������⣺��1��������22��Ԫ�أ�Ti2+������20�����ӣ����ݹ���ԭ��֪���̬��������Ų�ʽΪ��1s22s22p63s23p63d2 �� ��Χ�����Ų�ʽ�ɱ�ʾΪ3d2 �� ���Դ��ǣ�3d2����BH4����Bԭ�Ӽ۲���Ӷ�=4+ ![]() ��3+1��4��1��=4����û�йµ��Ӷԣ���������������ṹ�����Դ��ǣ��������壻��2��A��NH3������Nԭ�Ӻ���3�����õ��ӶԺ�һ���µ��Ӷԣ�������۲���Ӷ���4������sp3�ӻ�����A��ȷ��B����ͬѹǿʱ�������к��������PH3�в������������NH3�е��PH3�ߣ���B��ȷ��C��[Cu��NH3��4]2+�����У�Nԭ���ṩ�µ��Ӷԣ�����Nԭ������λԭ�ӣ���C��ȷ��D��CN����̼ԭ������8�����ȶ��ṹ��CN���ĵ���ʽΪ
��3+1��4��1��=4����û�йµ��Ӷԣ���������������ṹ�����Դ��ǣ��������壻��2��A��NH3������Nԭ�Ӻ���3�����õ��ӶԺ�һ���µ��Ӷԣ�������۲���Ӷ���4������sp3�ӻ�����A��ȷ��B����ͬѹǿʱ�������к��������PH3�в������������NH3�е��PH3�ߣ���B��ȷ��C��[Cu��NH3��4]2+�����У�Nԭ���ṩ�µ��Ӷԣ�����Nԭ������λԭ�ӣ���C��ȷ��D��CN����̼ԭ������8�����ȶ��ṹ��CN���ĵ���ʽΪ ![]() ����D��ȷ�����Դ��ǣ�ABCD����3���ٱ���CS2���ǷǼ��Է��ӣ�������������ԭ��֪��C60�ǷǼ��Է��ӣ����Դ��ǣ��Ǽ��ԣ������þ�̯��֪��ÿ��̼ԭ�Ӻ���
����D��ȷ�����Դ��ǣ�ABCD����3���ٱ���CS2���ǷǼ��Է��ӣ�������������ԭ��֪��C60�ǷǼ��Է��ӣ����Դ��ǣ��Ǽ��ԣ������þ�̯��֪��ÿ��̼ԭ�Ӻ��� ![]() ��3=
��3= ![]() ���� ��������1mol C60�����У����Ц� ����Ŀ=
���� ��������1mol C60�����У����Ц� ����Ŀ= ![]() ��1mol��60��NA/mol=90NA �� ���Դ��ǣ�90NA����4���þ�����þԭ�Ӹ���=
��1mol��60��NA/mol=90NA �� ���Դ��ǣ�90NA����4���þ�����þԭ�Ӹ���= ![]() ��8+1=2����ԭ�Ӹ���=2+4��
��8+1=2����ԭ�Ӹ���=2+4�� ![]() =4�����Ըþ�����þԭ�Ӻ���ԭ�Ӹ���Ϊ2��4=1��2�������仯ѧʽΪMgH2 �� ���Դ��ǣ�MgH2 ��
=4�����Ըþ�����þԭ�Ӻ���ԭ�Ӹ���Ϊ2��4=1��2�������仯ѧʽΪMgH2 �� ���Դ��ǣ�MgH2 ��


 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaOH��AlCl3��MgCl2���ֹ�����ɵĻ�����������ˮ�к���0.58g��ɫ�������ɣ������õĻ���Һ�У���μ���0.5mol/L���ᣬ������������(V)�����ɳ���������(W)��ϵ����ͼ��ʾ��
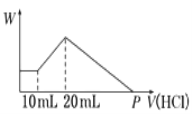
��1���������NaOH������Ϊ_________________
��2���������MgCl2������Ϊ_________________
��3���������AlCl3�����ʵ���Ϊ_________________
��4��P���ʾ����������_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ 2NH3N2+3H2 �� ��ij�¶��µ�ƽ�ⳣ��Ϊ0.25����ô���ڴ������£����ĺϳɷ�Ӧ ![]() N2+
N2+ ![]() H2NH3 ��ƽ�ⳣ��Ϊ�� ��
H2NH3 ��ƽ�ⳣ��Ϊ�� ��
A.4
B.2
C.1
D.0.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ�¶�ʱ��100mL 0.01mol/L�Ĵ�����Һ��10mL 0.1mol/L�Ĵ�����Һ��Ƚϣ�������ֵǰ�ߴ��ں��ߵ��ǣ� ��
A.�к�ʱ����NaOH����
B.��Mg��Ӧ����ʼ����
C.OH�������ʵ���Ũ��
D.��Һ�� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ǹ涨12C�����ԭ������Ϊ24����0.024kg12C��������ԭ�Ӹ���Ϊ�����ӵ�����(NA)����ô���м������������ܷ����仯���ǣ� ��һ��12Cԭ�ӵ����� �ڰ����ӵ�����(NA)��Ħ��������O2����Է�������������Ħ�������![]() gC2H5OH�����ʵ�����98%(
gC2H5OH�����ʵ�����98%( ![]() )��������ʵ���Ũ�Ȣ�44gCO2�����ķ��Ӹ���
)��������ʵ���Ũ�Ȣ�44gCO2�����ķ��Ӹ���
A. �ڢۢ� B. �٢� C. �٢ڢߢ� D. �٢ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���������к���NaCl���ʣ�Ϊ�ⶨ�����еĴ��������������������ͼ�е�װ�ý���ʵ�顣
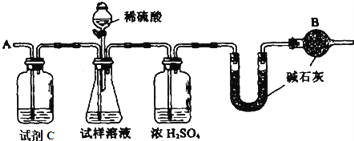
��Ҫʵ�鲽�����£�
�ٰ�ͼ��װ�����������װ�õ�������
�ڽ�a g����������ƿ�У�����������ˮ�ܽ⣬�õ�������Һ
�۳���ʢ�м�ʯ�ҵ�U�ܵ��������õ�b g
�ܴӷ�Һ©������6 mol��L-1�����ᣬֱ�����ٲ�������Ϊֹ
�ݴӵ���A����������һ�����Ŀ���
���ٴγ���ʢ�м�ʯ�ҵ�U�ܵ��������õ�c g
���ظ�����ݺ͢IJ�����ֱ��U�ܵ������������䣬Ϊd g
����պͻش����⣺
��1������������ƽ������Ʒʱ�������ƽ��ָ������ƫת��˵��___________��
��2��װ���и����B��������_______________��
��3���������Һ©���е����ỻ��Ũ����ͬ�����ᣬ���ԵĽ��___________����ƫ�ߡ�ƫ�ͻ䣩��
��4������ݵ�Ŀ����________________����5������ߵ�Ŀ����________________��
��5���������д�������������ļ���ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���Ͷ�����˽����������������̣��������̲صķḻ��Դͨ���ܵ����͵�����������������ָ��������������Ҫ�ɷ���
A. CH4B. COC. H2 D. NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����8.12�����۱�ը����һ�������軯��й¶���軯�����������ˮ���о綾�������ˮ��Ⱦ��Ϊ�����Ӷ��軯����˽⣬ͬѧ�Dz������Ͻ���ѧϰ��̽���� 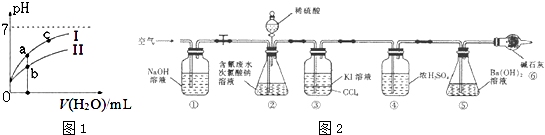
̽��һ��̽���軯�������
��֪��������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HCN | H2CO3 |
����ƽ�ⳣ�� | Ki=1.77��10��4 | Ki=5.0��10��10 | Ki1=4.3��10��7 |
��1��NaCN��Һ�ʼ��Ե�ԭ�����������ӷ���ʽ��ʾ��
��2����ͼ1��ʾ�����£�ϡ��HCOOH��HCN�������ϡ��Һʱ����ҺpH���ˮ���ı仯������˵����ȷ����
A.��ͬŨ�ȵ�HCOONa��NaCN�Ļ����Һ�У�������Ũ��
�Ĵ�С��ϵ�ǣ�c��Na+����c��CN������c��HCOO������c��OH������c��H+��
B.��NaCN��Һ��ͨ������������̼�����ӷ���ʽΪ��
CN��+CO2+H2O=HCN+CO32��
C.ͼ����a��c���㴦����Һ�� ![]() ��ȣ�HR����HCOOH��HCN��
��ȣ�HR����HCOOH��HCN��
D.ͼ����a�������Ũ��С��b�������Ũ��
��3��H2O2�С���ɫ�������������ƣ�Ҳ������ˮ�е��軯���KCN���������·�Ӧʵ�֣�KCN+H2O2+H2O�TA+NH3������������A�Ļ�ѧʽΪ ��
��4��̽�������ⶨ����ˮ���д����ٷ���
Ϊ�˲ⶨ����ˮ���д����ٷ��ʣ�ͬѧ��������ͼ2��ʾװ�ý���ʵ�飮��CN����Ũ��Ϊ0.2000mol/L�ĺ����ˮ100mL��100mL NaClO��Һ������������װ�â���ƿ�г�ַ�Ӧ����Һ©������������100mLϡH2SO4 �� �رջ�����
��֪װ�â��з�������Ҫ��Ӧ����Ϊ��
CN��+ClO���TCNO��+Cl��
2CNO��+2H++3C1O���TN2��+2CO2��+3C1��+H2O
������CN����ˮʱ������NaOH��Һ����pH��9ʱ����ʱc��CN����c��HCN�������������������=����
��5���ٺ͢������� ��
��6����Ӧ��������ͨ�˿�����Ŀ���� ��
��7��Ϊ�˼����ʵ��װ�â���ƿ�к����ˮ�������İٷ��ʣ�ʵ������Ҫ�ⶨװ����Ӧǰ�����������װ�âٵ�����ѡ����װ����ţ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com