
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究. 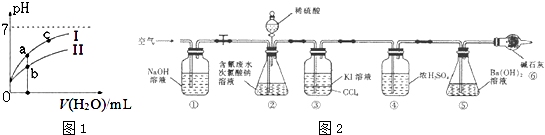
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 |
(1)NaCN溶液呈碱性的原因是(用离子方程式表示)
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN﹣+CO2+H2O=HCN+CO32﹣
C.图象中a、c两点处的溶液中 ![]() 相等(HR代表HCOOH或HCN)
相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为 .
(4)探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN﹣的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4 , 关闭活塞.
已知装置②中发生的主要反应依次为:
CN﹣+ClO﹣═CNO﹣+Cl﹣
2CNO﹣+2H++3C1O﹣═N2↑+2CO2↑+3C1﹣+H2O
处理含CN﹣废水时,如用NaOH溶液调节pH至9时,此时c(CN﹣)c(HCN)(填“>”、“<”或“=”)
(5)①和⑥的作用是 .
(6)反应结束后,缓缓通人空气的目的是 .
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置反应前后的质量(从装置①到⑥中选择,填装置序号).
【答案】
(1)CN﹣+H2O?HCN+OH﹣
(2)CD
(3)KHCO3
(4)<
(5)吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰
(6)使生成的气体全部进入装置⑤
(7)⑤
【解析】解:探究一:探究氰化物的性质(1.)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN﹣+H2OHCN+OH﹣ , 所以答案是:CN﹣+H2OHCN+OH﹣;
(2.)A、醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO﹣)>c(ClO﹣)>c(OH﹣)>c(H+),故A错误;B、碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO﹣+CO2+H2O═HClO+HCO3﹣ , 故B错误;
C、在 ![]() 的分子、分母同时乘以氢离子浓度可得:
的分子、分母同时乘以氢离子浓度可得: ![]() ,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故C正确;D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D正确.故选CD.所以答案是:CD;
,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故C正确;D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D正确.故选CD.所以答案是:CD;
(3.)H2O2被称为“绿色氧化剂”,其还原产物为水,H2O没有污染性,KCN+H2O2+H2O=A+NH3↑,由原子守恒可知A的化学式为KHCO3 , 所以答案是:KHCO3;
(4.)处理含CN﹣废水时,用NaOH溶液调节至pH=9时(常温),CN﹣+H2OHCN+OH﹣ , Ka(HCN)=5.0×10﹣10 , Kh= ![]() ×
× ![]() =
= ![]() =
= ![]() =2×10﹣5 , c(OH﹣)=10﹣5 , 则
=2×10﹣5 , c(OH﹣)=10﹣5 , 则 ![]() =2×10﹣5 , 则c(CN﹣)<c(HCN);所以答案是:<;
=2×10﹣5 , 则c(CN﹣)<c(HCN);所以答案是:<;
探究二:测定含氰水样中处理百分率
(5.)实验的原理是利用CN﹣+ClO﹣═CNO+Cl﹣;2CNO﹣+2H++3ClO﹣═N2↑+2CO2↑+3Cl﹣+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置⑤实验数据的测定产生干扰,装置①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰,
所以答案是:吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰;
(6.)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置⑤,以减少实验误差,
所以答案是:使生成的气体全部进入装置⑤;
(7.)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,则需要测定装置⑤反应前后的质量,所以答案是:⑤.


科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料. ①Ti2+基态的外围电子排布式可表示为 .
②BH4﹣的空间构型是(用文字描述).
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 ![]() 2NH3实现储氢和输氢.下列说法正确的是(多项选择).
2NH3实现储氢和输氢.下列说法正确的是(多项选择).
A.NH3分子中N原子采用sp3杂化
B.相同压强时,NH3沸点比PH3高
C.[Cu(NH3)4]2+离子中,N原子是配位原子
D.CN﹣的电子式为[:C┇┇N:]﹣
(3)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子. ①C60晶体易溶于苯、CS2 , C60是分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ键数目为 .
(4)一种由Mg和H元素组成的物质是金属氢化物储氢材料,其晶胞结构如图2所示,该物质化学式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取绿矾(FeSO47H2O),设计了如下流程,下列说法不正确的是( )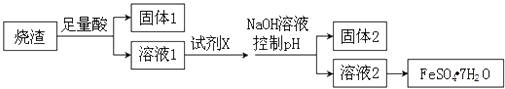
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH是为了使Al3+转化为Al(OH)3 , 进入固体2
C.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
D.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.。已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为
A. C30H60B. C30H56C. C30H52D. C30H50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上.
(1)下列物质不属于硅酸盐的是
A.陶瓷
B.玻璃
C.水泥
D.生石灰
(2)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为 , 工艺师常用(填物质名称)来雕刻玻璃.
(3)用Na2SiO3溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作 , Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是 .
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氯化铝坩埚 D.铁坩埚
(4)工业上常用2C+SiO2 ![]() Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是(填化学式,下同),氧化剂是 .
Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是(填化学式,下同),氧化剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池广泛用作各种电子仪器的电源,它的电池反应是Zn+Ag2OH2O=2Ag+Zn(OH)2则负极上发生反应的物质是( )
A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I是一种新型香料的主要成分之一,其结构中含有三个六元环.I的合成路线如下(部分产物和部分反应条件略去): 
已知:①A中核磁共振氢谱图显示分子中有6种不同化学环境的氢原子.
② ![]()
③C和H是同系物
请回答下列问题:
(1)A→B的化学方程式为 .
D→E 的化学方程式为 .
(2)写出G分子中含有的官能团名称: .
(3)C和H生成I的反应类型为 .
(4)I的结构简式为 .
(5)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的H的同分异构体有种(不包括立体异构),其中核磁共振氢谱为5组峰的为(写结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。

(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为_____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2,还原为Mn2+,反应的离子方程式为_____________________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2 Na2S2O3=2Na1+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是___________________________;
②用注射器抽取某水样20. 00mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入23滴_______作指示剂;
⑧用0.005 mol L -1 Na2S2O3溶液滴定至终点。滴定终点的现象是___________________________。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________ mg L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将_________ (填“偏大”“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com