
【题目】运用氧化还原反应的有关知识回答下列问题.
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质.则在Cu、Fe、Ag中,的还原性最强;在Cu2+、Fe2+、Ag+中,的氧化性最强.
(2)在下列反应中:
A.2F2+2H2O═4HF+O2 B.2Na+2H2O═2NaOH+H2↑
C.CaO+H2O═Ca(OH)2 D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
①水只作还原剂的是
②水既不作氧化剂又不作还原剂的是 .
(3)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O. 取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L.
MnCl2+Cl2↑+2H2O. 取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L.
请回答下列问题:
①写出该反应的离子方程式 .
②该反应中,氧化剂是 , 氧化产物是 .
③反应中被氧化的HCl的物质的量为 .
④实验室备用的浓盐酸质量分数为36.5%,密度为1.19gcm﹣3 , 为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 .
【答案】
(1)Fe;Ag+
(2)A;C
(3)MnO2+2Cl﹣+4H+ ![]() Mn2++Cl2↑+2H2O;MnO2;Cl2;2mol;11.9mol/L
Mn2++Cl2↑+2H2O;MnO2;Cl2;2mol;11.9mol/L
【解析】解:(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,故还原性最强的是Fe;Cu2+、Fe2+、Ag+中氧化性强弱为Ag+>Cu2+>Fe2+ , 氧化性最强的是Ag+;
所以答案是:Fe;Ag+; (2)A.2F2+2H2O═4HF+O2 , O元素的化合价升高,是还原剂;
B.2Na+2H2O═2NaOH+H2↑氢元素的化合价降低是氧化剂;
C.CaO+H2O═Ca(OH)2 无元素化合价的变化;
D.2H2O ![]() 2H2↑+O2↑,水既是氧化剂,也是还原剂;
2H2↑+O2↑,水既是氧化剂,也是还原剂;
所以答案是:①A; ②C;(3)①反应离子方程式为:MnO2+2Cl﹣+4H+ ![]() Mn2++Cl2↑+2H2O,所以答案是:MnO2+2Cl﹣+4H+
Mn2++Cl2↑+2H2O,所以答案是:MnO2+2Cl﹣+4H+ ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②二氧化锰是氧化剂,浓盐酸是还原剂,所以答案是:MnO2;Cl2;
③被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl的物质的量为1mol×2=2mol,所以答案是:2mol;
④根据c= ![]() 可知,浓盐酸质量分数为36.5%,密度为1.19gcm﹣3 , 则该浓盐酸的物质的量浓度为
可知,浓盐酸质量分数为36.5%,密度为1.19gcm﹣3 , 则该浓盐酸的物质的量浓度为 ![]() mol/L=11.9mol/L,所以答案是:11.9mol/L.
mol/L=11.9mol/L,所以答案是:11.9mol/L.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】下列化合物的核磁共振氢谱中出现三组峰的是( )
A.2,2,3,3﹣四甲基丁烷
B.2,3,4﹣三甲基戊烷
C.3,4﹣二甲基己烷
D.2,5﹣二甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个圆所构成的元素概念的关系图,其中4为最大圆,3、2、1依次减小.试判断符合这种关系的是( )
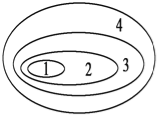
A. 1.大量元素、2.主要元素、3.基本元素、4.最基本元素
B. 1.基本元素、2.最基本元素、3.大量元素、4.主要元素
C. 1.最基本元素、2.基本元素、3.主要元素、4.大量元素
D. 1.主要元素、2.大量元素、3.最基本元素、4.基本元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员为了比较甲、乙、丙三种微生物所产生的淀粉酶(提取液中酶蛋白浓度相同)的活性,进行了如下实验:
分组试剂(mL) | 试管1 | 试管2 | 试管3 | 试管4 |
蒸馏水 | 2 | 2 | 2 | A |
pH=8缓冲液 | 0.5 | 0.5 | 0.5 | 0.5 |
淀粉溶液 | 1 | 1 | 1 | 1 |
甲生物提取液 | 0.3 | |||
乙生物提取液 | 0.3 | |||
丙生物提取液 | 0.3 | |||
总体积 | 3.8 | 3.8 | 3.8 | B |
结果如下表(注:“+”显色,“++”显色更深;“﹣”不显色),请分析回答下列问题:
试管1 | 试管2 | 试管3 | 试管4 | |
颜色深浅程 | ++ | ﹣ | + | C |
(1)表中A的数值为 ,C的颜色深浅程度 (用“+“或“﹣”表示).
(2)该实验的自变量是 ,无关变量有 (写出2种即可).
(3)除了用碘液检验淀粉的剩余量来判断实验结果外,还可以用 试剂来检测生成物的量.若用该试剂检验,颜色变化最深的试管是 .
(4)根据上述结果得出的结论是:不同来源的淀粉酶,虽然酶蛋白浓度相同,但活性不同.造成实验中三种酶活性差异的根本原因是 .
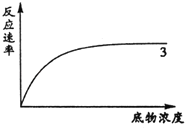
(5)同学们还做了反应速率与底物浓度关系的实验.右上坐标中已根据实验结果画出3号试管中酶活性的曲线,请你在坐标中画出2号试管中酶活性的曲线. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是生活必需品,也是重要的化工原料.提纯含少量泥沙的粗盐,一般经过以下操作流程: 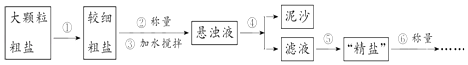
(1)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是 .
(2)实验结束后称量获得的“精盐”,并计算“精盐”的制得率,发现制得率较低,其可能原因是(填序号).
A.粗盐没有全部溶解即过滤
B.蒸发时液滴飞溅剧烈
C.蒸发后所得“精盐”很潮湿
D.蒸发皿上粘有的“精盐”没有全部转移到称量纸上
(3)小明查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的MgCl2、CaCl2等可溶性杂质.为了得到较纯净的氯化钠,小明将上述流程图中操作⑤得到的“精盐”又作了如下处理(假定杂质只有MgCl2、CaCl2两种). 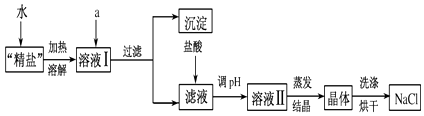
①提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、KOH溶液、饱和NaCl溶液.
从提供的试剂中选出a所代表的试剂是、 , 写出发生反应的离子方程式 , .
②在滤液中加盐酸的作用是、(用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下NO2是无色气体,能与水发生反应
B.SiO2难溶于水,不能与NaOH溶液反应
C.浓硝酸能与铜反应生成H2
D.实验室常用NH4Cl和Ca(OH)2固体混合物加热来制取NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com