
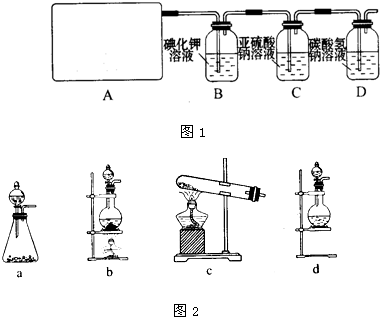
 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质.
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质.
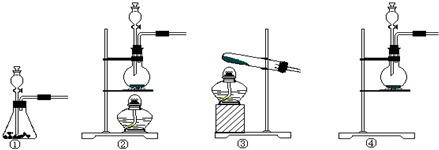
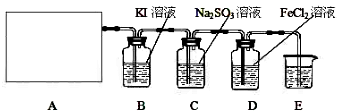
 2CaSO4+2Cl2↑+2H2O,应在加热的条件下反应,氯气具有强氧化性,可与KI反应生成I2,可与FeCl2反应生成FeCl3,氯气有毒,不能排放到空气中,由于可与碱反应,则可用NaOH溶液进行尾气的吸收,以此解答该题.
2CaSO4+2Cl2↑+2H2O,应在加热的条件下反应,氯气具有强氧化性,可与KI反应生成I2,可与FeCl2反应生成FeCl3,氯气有毒,不能排放到空气中,由于可与碱反应,则可用NaOH溶液进行尾气的吸收,以此解答该题.

科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com