
【题目】硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。

已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。 回答下列问题:
(1)仪器C的名称是___________,冷凝管的进水方向______(填“a”或“b”)。
(2)乙、丁中的试剂是_______________________。
(3)下列操作或描述正确的是_________________。
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 molL-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:_____________。
(5)长期储存的硫酰氯会发黄,可能的原因是:_______。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为_______。(产率=![]() ×100%)
×100%)
【答案】蒸馏烧瓶 a 浓硫酸 BD 2ClSO3H![]() SO2Cl2+H2SO4 SO2Cl2=SO2+Cl2,分解产生的氯气溶解在其中 75%
SO2Cl2+H2SO4 SO2Cl2=SO2+Cl2,分解产生的氯气溶解在其中 75%
【解析】
本实验目的是用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,甲为制取二氧化硫装置,戊为制取氯气装置,乙和丁均为除杂装置,己为吸收空气中水蒸气装置和吸收尾气。(6)中,根据物质的量之比等于化学方程式中计量数之比可推得,消耗氯气的量等于理论生成硫酰氯的物质的量,进而计算硫酰氯的产率。
(1)仪器C为蒸馏烧瓶,冷凝水的流向是“下进上出”,所以装置丙冷凝管的进水入口为a;
因此,本题正确答案是:蒸馏烧瓶;a;
(2)乙的作用是干燥SO2,丁的作用是干燥氯气,所以乙、丁中的试剂都是浓硫酸;
因此,本题正确答案是:浓硫酸;
(3)A.98.3%硫酸缺少水,硫酸电离很少,大多以分子形式存在,而Na2SO3(s)和H2SO4的反应是在H2SO4电离成离子的情况下才能顺利进行,故A错误;
B. 同温同压下,实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等,故B正确;
C. 装置戊上方分液漏斗中最好选用饱和NaCl溶液,才能减小氯气的溶解度,故C错误;
D.装置己可吸收二氧化硫和氯气,防止污染,同时吸收空气中的水,防止硫酰氯变质,故D正确。
因此,本题正确答案是:BD;
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,根据质量守恒配平,反应方程式为:2ClSO3H![]() SO2Cl2+H2SO4,
SO2Cl2+H2SO4,
因此,本题正确答案是:2ClSO3H![]() SO2Cl2+H2SO4;
SO2Cl2+H2SO4;
(5)由分解反应SO2Cl2=SO2+Cl2可知,分解产生少量氯气,氯气为黄绿色,溶解在其中,会导致硫酰氯发黄;
因此,本题正确答案是:SO2Cl2=SO2+Cl2,分解产生的氯气溶解在其中;
(6) 若反应中消耗的氯气体积为896 mL(标准状况下),氯气的物质的量为0.04mol,由化学方程式SO2+Cl2 =SO2Cl2可知,理论上生成硫酰氯0.04mol,
所以硫酰氯的理论产量m=nM=![]() (32+32+71)g/mol=5.4g,
(32+32+71)g/mol=5.4g,
产率=![]() 100%=
100%=![]() 100%=75%。
100%=75%。
因此,本题正确答案是:75%。


科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是( )
A.晶体硅具有金属光泽、能导电,属于金属材料
B.硅的化学性质比较稳定,在自然界中主要以游离态存在
C.二氧化硅是一种酸性氧化物,能够与水反应生成相应的酸
D.加入适量的稀盐酸可以除去二氧化硅中混有的碳酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)![]() 2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是
2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是
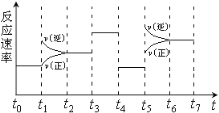
A. t6~t7阶段,C的百分含量最大
B. t2~t3阶段,A的转化率最小
C. t3时,改变因素一定是使用了催化剂
D. t5时,改变因素一定是升高了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,4L H2和O2的混合气体爆炸后恢复到原来状态,其体积变为3L。则原混合气体中H2和O2的体积比可能为( )
A.1:2B.1:3C.3:1D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A,B混合于2L的密闭容器中,发生反应3A(g)+B(g)![]() xC(g)+2D(g)。经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin)。试求:
xC(g)+2D(g)。经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin)。试求:
(1)x的值______;
(2)B的平均反应速率______;
(3)A的平衡浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 为中学常见单质,其中一种为金属;通常情况下,A 为固体,B 为液体,C 为气体。D、 E、F、G、H、X 均为化合物,其中 X 是一种无氧强酸、E 为黑色固体,H 在常温下为液体。它们之间的 转化关系如图所示(其中某些反应条件和部分反应物已略去)。

(1)写出化学式:A____________、D__________、E__________、X________。
(2) 在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3) 反应⑥的离子方程式为__________。
(4)反应⑦的化学方程式为__________,该反应中每消耗 0.3molA,可转移电子__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、W 四种短周期元素的原子序数依次增大。其中 X 与 Y、Z、W 所形成的常见化合 物(10e 或 18e)在常温下均为气态,在元素周期表中 Z 与 W 相邻,Y 的最高价氧化物的水化物与其氢化 物反应生成盐,且 Y 的核电荷数与 W 的最外层电子数相同。
(1)Z 离子的结构示意图是_____。
(2) X、Y、W 可组成一种化合物,原子个数比为 4:1:1,该化合物的化学式是_____,其中含有的化学键 有_____。
(3)X 与 Y 所形成的分子的电子式为_____,它比同主族其他元素的氢化物沸点高的原因是______。
(4)请从 Z、W 的结构上说明 Z、W 两种元素非金属性的强弱_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如右图。下列说法中不正确的是( )

A. Y代表盐酸与镁条的反应
B. a点时反应Y消耗镁条的量少
C. b点表示此时两溶液pH相等
D. c点表示此时反应结束
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃,,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 1 | 2 | 0 |
平衡浓度/(mol·L-1) | 0.6 | 1.2 | 0.8 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为40%
B. 反应可表示为X(g)+2Y(g) ![]() 2Z(g),其平衡常数为0.74
2Z(g),其平衡常数为0.74
C. 其它条件不变时,增大压强能使平衡向生成Z的方向移动,平衡常数也增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com