
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl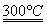 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
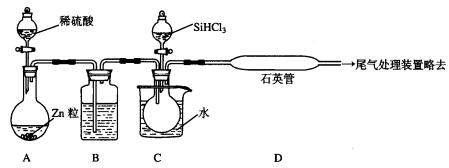
①装置B中的试剂是_________________________。
装置C中的烧瓶需要加热,其目的是_____________________________________。
②反应一段时间后,装置D中观察到的现象是______________________________________,装置D不能采用普通玻璃管的原因是____________________________________,装置D中发生反应的化学方程式为__________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_________________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
【答案】
(1)SiO2+2C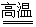 Si+2CO↑
Si+2CO↑
(2)分馏(或蒸馏)
(3)①浓硫酸
使滴入烧瓶中的SiHCl3气化
②有固体物质生成
在反应温度下,普通玻璃会软化
SiHCl3+H2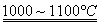 Si+3HCl
Si+3HCl
③排尽装置中的空气
④b d
【解析】(1)高温用C还原SiO2生成CO而不是CO2。
(2)分离、提纯不同沸点的液体可以采用分馏或蒸馏的方法。
(3)用Zn、稀H2SO4制得的H2会混有少量H2O,而SiHCl3能与H2O剧烈反应,所以要进行干燥,根据装置选择液态干燥剂浓硫酸。C装置用水浴加热SiHCl3使其挥发成气体,和H2进入D装置反应。因为SiHCl3+H2 Si+2HCl的温度很高,不能使用普通玻璃管。因为SiHCl3容易在空气中自燃,实验中还要注意先通一段时间H2排尽装置中的空气。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某溶液中可能含有K+、NH4+、Ba2+、SO42一、I一、 CO32一。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色。为确定该溶液的组成,还需检验的离子是 ( )
A.K+ B.SO42一 C.Ba2+ D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下
列结论正确的是
A.X是强酸,Y是弱酸 B.X是弱酸,Y是强酸
C.X是二元酸,Y是一元酸 D.无法判断X、Y的上述性质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl-的物质的量浓度最大的是( )
A.300 mL 3.5 mol/L KCl溶液 B.1 000 mL 2.5 mol/L NaCl溶液
C.250 mL 1 mol/L AlCl3溶液 D.200 mL 2 mol/L MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
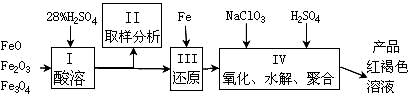
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比
(b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量
(d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + 2NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42ˉ与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42ˉ与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂质的方法不可行的是
A 用过量氨水除去Al3+溶液中的少量Fe3+
B 将混合气体通过灼热的铜网除去N2中少量O2
C 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D 用盐酸除去AgCl中少量的Ag2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电化学的实验事实正确的是
|
| 出现环境 | 实验事实 |
| A. | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B. | 电解CuCl2溶液 |
|
| C. | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
| D. | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成。 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 。 | 使溶液褪色的气体是乙烯 |
| D | 向饱和Na2CO3中通入足量CO2 ,溶液变浑浊 | 析出了NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com