
【题目】NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.0.1mol/L NaCI溶液中所含Na+数目为0.1NAB.1mol NH3所含有的原子数为NA
C.标准状况下,22.4L水中所含原子数为3NAD.常温常压下,48g O3所含的原子数为3NA
科目:高中化学 来源: 题型:
【题目】298K时,用0.1000mol/L NaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0)

下列有关叙述正确的是
A. 该滴定过程应该选择甲基橙作为指示剂
B. 图中a、b两点氷的电离程度:b>a
C. 当加入10.00mL NaOH溶液时,溶液中:c(HCOO)>c(H+)>c(Na+)>c(OH)
D. 当加入20.00mL NaOH溶液时,溶液pH>8.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是
A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D. 如图所示是树林中的晨曙,该反应与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____种,第一电离能比P大有____种。
(3)PH3分子的空间构型为___________。PH3的键角小于NH3的原因是__________。
(4)化合物(CH3)3N能溶于水,试解析其原因____________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为________。
②已知晶胞边长a pm,阿伏加德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
I.(1)用甲醇制取甲胺的反应为![]() △H
△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=__________kJ·mol-1
Ⅱ.一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应
主反应:![]() △H<0 Ⅰ
△H<0 Ⅰ
副反应:![]() △H<0 Ⅱ
△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)如图所示:
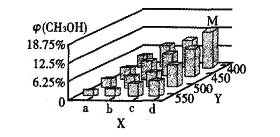
(2)图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是__________
(3)若反应II的平衡常数K值变小.则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动
B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小
D.容器中φ(CH3OCH3)增大
(4)平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为________;用H2表示I的反应速率为______mol·L-1·min-1。反应Ⅱ的平衡常数K=___________(用分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液中离子关系的说法正确的是( )
A. 0.1 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
B. 把0.2 mol/L NH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后离子浓度关系:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C. 常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-)
D. 在Na2CO3溶液中,c(H+)+c(![]() )+c(H2CO3)= c(OH-)
)+c(H2CO3)= c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定),且有气体剩余。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
①粉末中一定有Na2O、Na2O2、和NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O2和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是某学生设计的实验室制备并干燥Cl2及吸收多余氯气的实验装置图,请回答:

(1)指出上图中的各处错误:
①____________________________________________________
②____________________________________________________
③____________________________________________________
④____________________________________________________
(2)制备实验开始时,先检查装置的气密性,接下来的操作依次是 ________
A、向烧瓶中加入MnO2粉末 B、加热 C、向烧瓶中加入浓盐酸
(3)如果将过量二氧化锰与20mL 12mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol。其主要原因有:
①____________________________________________________
②____________________________________________________
(4)为了提高浓盐酸的利用率,你对实验的建议是:
①____________________________________________________
②____________________________________________________
(5)写出圆底烧瓶中发生反应的离子反应方程式,并用单线桥表示电子转移的方向和数目________________
(6)NaClO是84消毒液的有效成分。请回答下列问题
①浸泡衣物时加入84消毒液在空气中放置一段时间漂白效果更好,结合离子方程式解释原因 ____________(已知酸性:H2CO3 >HClO>HCO3-)
②若将84消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是____________________________________________;
(7)Cl2是一种有毒气体,如果泄露会造成严重的危害。
①已知:3Cl2 + 8NH3 = 6NH4Cl +N2,化工厂可用浓氨水来检验Cl2是否泄露,该反应中被氧化和未被氧化的NH3的物质的量比________ ;
②喷射石灰乳等碱性物质可以减轻少量Cl2泄露造成的危害,Cl2与石灰乳反应的化学方程式是____________
③实验室常用烧碱溶液吸收Cl2,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合溶液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com