
【题目】反应2A(g)+B(g)![]() 3C(g)+D(g),△H=akJ/mol。反应过程中的能量变化如图所示。回答下列问题:
3C(g)+D(g),△H=akJ/mol。反应过程中的能量变化如图所示。回答下列问题:
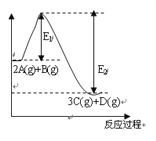
⑴a_____0 (填“<”“>”“=”)。
⑵该反应的熵变 △s_______0 (填“<”“>”“=”),在_________(填“高”、“低”、“任何”)温度能正向自发进行。
⑶若反应在恒容恒温条件下进行,且A、B的起始浓度分别为 5mol/L、2mol/L,10min后平衡时D的浓度为1mol/L,C物质的量为3mol,则容器的容积为_________L,B的转化率为________,A的反应速率为______________,化学平衡常数为___________。
【答案】 < > 任何 1 50% 0.2mol/(L·min) 3
【解析】(1)由能量变化图可知,反应物的总能量大于生成物,此反应为放热反应,即△H<0,则a<0;此可逆反应升高温度时,平衡逆向移动,平衡常数减小;(2)已知反应2A(g)+B(g)3C(g)+D(g),正方向是气体总量增大的方向,即△s>0;已知此反应的△H<0、△s>0,根据△G=△H-T△s可知,在任何温度下,△G均小于0,即均能自发进行;
(3) 2A(g)+B(g)3C(g)+D(g)
起始浓度(mol/L) 5 2 0 0
变化浓度(mol/L) 2 1 3 1
平衡浓度(mol/L) 3 1 3 1
则:容器的体积V=![]() =1L;B的转化率为:
=1L;B的转化率为:![]() ×100%=50%;A的平衡反应速率为:
×100%=50%;A的平衡反应速率为:![]() =0.2mol/(Lmin);此反应的平衡常数K=
=0.2mol/(Lmin);此反应的平衡常数K=![]() =
=![]() =3。
=3。


科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
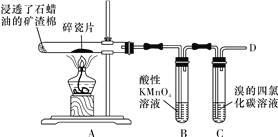
(1)A中碎瓷片的作用是____________。
(2)乙烯的电子式为__________________。
(3)下列物质中,可以通过乙烯的加成反应得到的是______(填字母代号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有_______溶液的硅藻土放置在盛放水果的容器中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A.Al(OH)3受热能分解
B.Al2O3既能溶于强酸溶液又能溶于强碱溶液
C.Al(OH)3胶体能吸附水中的悬浮物
D.Al(OH)3能溶于过量的浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH4+
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3具有热不稳定性
D. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO
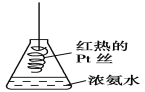
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标况下,11.2LCCl4中含有共价键数目为2NA
B. 1 mol Cl2 与足量的铁反应转移的电子数目是3NA
C. 2molSO2和1mol18O2充分反应,产物中含18O原子数为2NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁在生产和生活中有着广泛的应用。某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。

在相同条件下,三组装置中铁电极腐蚀最快的是_____________(填装置序号),该装置中正极电极反应式为___________________________;为防止金属Fe被腐蚀,效果最好的为上述的_____________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为__________________________________________________。
(2)燃料电池作为新型电池,越来越多地应用于日常生活,该学习小组设计了以下电池:将两个多孔的石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成燃料电池。其中通入CH4的电极是电极反应式___________________________________,电池工作期间,OH-应向_______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:1molH2(g)与1molBr2(g)完全反应生成2molHBr(g)时放出72kJ的热量,有关物质的相关数据如下表:则表中a为
化学键 | H-H | Br- Br | H-Br |
断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
A. 200B. 230C. 260D. 404
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、H+、CO32-B.Fe2+、SO42-、OH-
C.Na+、Cl-、Ag+D.K+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com