
【题目】写出下列物质的电离方程式
(1)Ba(OH)2__________________________________________
(2)Na2CO3___________________________________________
(3)CH3COOH____________________________
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物的摩尔质量为17g/mol;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.XZ2、M2Z2均为共价化合物
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质硬度一定很大
D.由X、Y、Z、M四种元素形成的化合物只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D是食品中的常见有机物,A是生物的主要供能物质。以A和水煤气(CO、H2)为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知E是CO和H2以物质的量之比1:2反应的产物,F为具有特殊香味、不易溶于水的油状液体。

请回答:
(1)有机物D中含有的官能团名称是______。
(2)B→C化学方程式是______。
(3)下列说法不正确的是______(填字母)。
A.有机物B与金属钠反应比水与金属钠反应要剧烈
B.除去F中含有D、E杂质可用NaOH溶液洗涤、分液
C.D和E反应生成F时,浓硫酸主要起强氧化剂作用
D.C在一定条件下可以与H2反应转化为B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,对应离子一定能大量共存的是
A.在0.1mol/LNa2CO3溶液中:Al3+、![]() 、
、![]() 、
、![]()
B.pH=7的溶液中:Fe3+、Cl-、Na+、![]()
C.使甲基橙变红的溶液中:![]() 、Cl-、
、Cl-、![]() 、Mg2+
、Mg2+
D.25℃时,水电离出的 c(H+)=1×l0-13 mol/L的溶液中:K+、Ba2+、![]() 、S2-
、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3 可作防火剂 |
B | 将 H2 在充满Cl2 的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2 化合生成HCl |
C | 将 SO2 通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2 具有氧化性 |
D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有 CoO(OH)、CoCO3、Cu2(OH)2CO3 和 SiO2,及一定量的 Fe2O3、MgO 和CaO等。由该矿石制Co2O3的部分工艺流程如图:
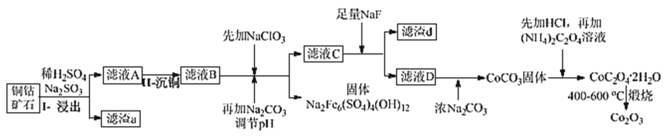
(1)在“浸出”过程中可以提高反应速率的方法有__。(写出两种即可)
(2)在“II-沉铜”过程中加入了FeS固体,得到更难溶的CuS,写出该步反应的离子方程式__。
(3)NaClO3 的主要作用是__。
(4)滤渣d 的主要成分是__。
(5)滤液D 中加入浓Na2CO3 后又加入HCl 溶解,其目的是__。
(6)写出CoC2O4·2H2O 在空气中煅烧得到 Co2O3 的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁是合成锂离子电池正极材料磷酸亚铁锂的原料。某工厂以炼钢厂的脱硫渣(主要成分是Fe2O3)为原料生产电池级草酸亚铁晶体的工艺流程如下:
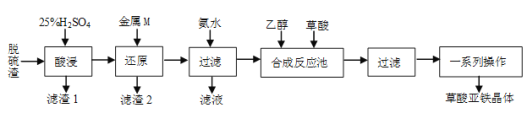
(1)要提高“酸浸”速率,宜采取的措施有___(填两条)。
(2)写出“还原”过程中既是化合反应又是氧化还原反应的离子方程式___。
(3)滤渣2中含有的TiOSO4在热水中易水解,生成H2TiO3,该反应的化学方程式为___。
(4)“滤液”经处理后得到一种化肥,其化学式为___。“一系列操作”指___。
(5)已知:298K时,Ksp[Fe(OH)2]=4.0×10-17,当离子浓度≤1.0×10-5molL-1时,视该离子已完全沉淀。上述流程中,加“氨水”调pH的范围为___(lg2≈0.3)。
(6)草酸亚铁晶体(FeC2O42H2O)纯度的测定:准确称取mg草酸亚铁晶体于锥形瓶中,加入一定量的稀硫酸溶液,并加热至50℃,用cmolL-1KMnO4标准溶液滴定,达到滴定终点时,用去标准溶液VmL。滴定反应(未配平):FeC2O42H2O+KMnO4+H2SO4→Fe2(SO4)3+CO2+MnSO4+K2SO4+H2O;则样品中FeC2O42H2O的纯度为___%(用含有m、c、V的代数式表示);若草酸亚铁晶体失去部分结晶水,测得的结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是( )
①Na![]() Na2O2
Na2O2![]() Na2CO3
Na2CO3
②MgO![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
③Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
④SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
⑤HCHO![]() HCOOH
HCOOH![]() HCOOCH3
HCOOCH3
A.①②③B.②③④C.②③⑤D.①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com