
【题目】某铜钴矿石主要含有 CoO(OH)、CoCO3、Cu2(OH)2CO3 和 SiO2,及一定量的 Fe2O3、MgO 和CaO等。由该矿石制Co2O3的部分工艺流程如图:
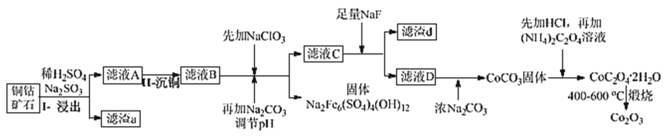
(1)在“浸出”过程中可以提高反应速率的方法有__。(写出两种即可)
(2)在“II-沉铜”过程中加入了FeS固体,得到更难溶的CuS,写出该步反应的离子方程式__。
(3)NaClO3 的主要作用是__。
(4)滤渣d 的主要成分是__。
(5)滤液D 中加入浓Na2CO3 后又加入HCl 溶解,其目的是__。
(6)写出CoC2O4·2H2O 在空气中煅烧得到 Co2O3 的化学方程式__。
【答案】升高温度或将矿石粉碎或适当增大硫酸的浓度等(只要两条即可) ![]() 将Fe2+氧化为Fe3+ MgF2、CaF2 富集Co2+ 4CoC2O42H2O+3O2
将Fe2+氧化为Fe3+ MgF2、CaF2 富集Co2+ 4CoC2O42H2O+3O2![]() 2Co2O3+8CO2↑+8H2O
2Co2O3+8CO2↑+8H2O
【解析】
铜钴矿中加入过量稀硫酸和Na2SO3,得到的滤液A含Co2+、Cu2+、Fe2+、Mg2+、Ca2+,加入的Na2SO3主要是将Co3+、Fe3+还原为Co2+、Fe2+,沉铜后加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH,可以使Fe3+沉淀,过滤后所得滤液主要含有Co2+、Mg2+、Ca2+,再用NaF溶液除去钙离子、镁离子,过滤后,向滤液中加入浓Na2CO3溶液转为CoCO3固体,碳酸钴先用盐酸溶解、最后加入草酸铵溶液得到草酸钴,煅烧后制得Co2O3。
(1)“浸泡”过程中可以加快反应速率的方法是升温、粉碎矿石、适当增加稀硫酸浓度等;故答案为:升高温度、将矿石粉碎、适当增大硫酸的浓度等
(2)在“II-沉铜”过程中加入了FeS固体,得到更难溶的CuS,即Cu2+与FeS反应生成CuS和Fe2+,故该步反应的离子方程式为:![]() ,故答案为:
,故答案为:![]()
(3)由于铜钴矿中+3价的Fe3+被Na2SO3还原成了Fe2+,而加入NaClO3溶液后,再加入碳酸钠溶液调节pH得到了+3价的Na2Fe6(SO4)4(OH)12,故可推知加入NaClO3溶液能发生反应ClO3-+6Fe2++6H+═Cl-+6Fe3++3H2O,故主要目的是将Fe2+氧化为Fe3+;故答案为:将Fe2+氧化为Fe3+;
(4)由上述分析可知,滤液C中含有大量Ca2+、Mg2+,加入NaF后将转化成MgF2、CaF2,滤渣d 的主要成分是MgF2、CaF2,故答案为:MgF2、CaF2;
(5)滤液D中加入浓Na2CO3,将滤液中的Co2+转化为CoCO3沉淀后又加入HCl溶解生成Co2+再与草酸铵反应液,其目的是提高Co2+的浓度和纯度,故答案为:富集Co2+;
(6)由钴的化合价分析可知,CoC2O4·2H2O在空气中煅烧得到Co2O3的反应是一个氧化还原反应,故其化学方程式为4CoC2O42H2O+3O2![]() 2Co2O3+8CO2↑+8H2O,故答案为:4CoC2O42H2O+3O2
2Co2O3+8CO2↑+8H2O,故答案为:4CoC2O42H2O+3O2![]() 2Co2O3+8CO2↑+8H2O。
2Co2O3+8CO2↑+8H2O。


科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )

A.Ka(HA)=1×10-6mol/L
B.b点c(B+)=c(A-)=c(OH-)=c(H+)
C.c点时,![]() 随温度升高而减小
随温度升高而减小
D.a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
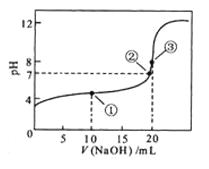
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电离方程式
(1)Ba(OH)2__________________________________________
(2)Na2CO3___________________________________________
(3)CH3COOH____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问題。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;水的电离程度将________(填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________(填字母)。
a.![]() 、
、![]() b.
b.![]() 、
、![]() c.
c.![]() 、
、![]() d.H2SO3、
d.H2SO3、![]()
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______。
(4)0.1 mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中 c(H2A)________c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________(用文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
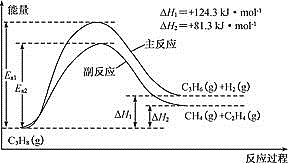
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)______(填“增大”、“减小”或“不变”)
②温度升高,副反应更容易发生的主要原因是:_____________________________。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)
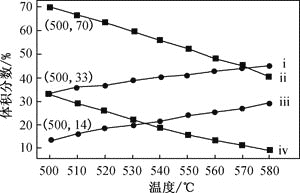
①104Pa时,图中表示丙烯的曲线是_________(填“i”、“ii”、“iii”或“iv”)
②104Pa、500℃时,主反应用平衡分压代替平黄浓度表示的化学平衡常数Kp=______(已知:气体分压=气体总压×体积分数)
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图
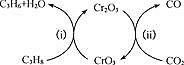
已知:CO和H2的燃烧热分别为H=-283.0kJ·mol-1、H=-285.8kJ·mol-1
①图中催化剂为___________。
②298K时,该工艺总反应的热化学方程式为____________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常见高分子聚合物的说法正确的是
A.苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为![]()
B.聚-1,3-丁二烯(![]() )是一种碳碳双键和碳碳单键1:1依次交替排列的高分子
)是一种碳碳双键和碳碳单键1:1依次交替排列的高分子
C.![]() 是由对苯二甲酸和乙二醇通过缩聚反应得到的
是由对苯二甲酸和乙二醇通过缩聚反应得到的
D.硫化橡胶具有较高的强度和化学稳定性,是一种线型高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某医药中间体G的一种合成路线如下:

已知:(1)A的核磁共振氢谱有两组峰,且峰面积之比为3∶1;
(2)G的结构简式为:![]() ;
;
(3)![]() 。
。
回答下列问题:
(1)A的名称是_____________;B→C的反应类型是_____________。
(2)G的分子式为___________;G中官能团名称是_____________;1 mol G与NaOH溶液反应最多消耗______ mol NaOH。
(3)H的结构简式为_____________。
(4)D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式_________________________________。
(5)I与F互为同分异构体,则满足下列条件的I的结构有______种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
(6)根据题中所给信息,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯的合成路线(其它无机试剂任选):_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是

A.用水湿润的pH试纸测量某溶液的pH
B.用量筒量取20 mL0.5000 mol·L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol· L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置除去Cl2中的少量HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com