
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
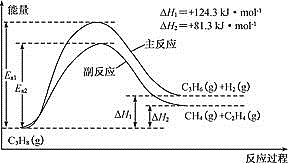
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)______(填“增大”、“减小”或“不变”)
②温度升高,副反应更容易发生的主要原因是:_____________________________。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)
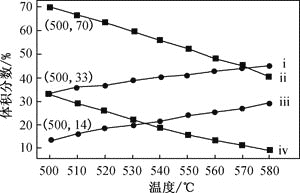
①104Pa时,图中表示丙烯的曲线是_________(填“i”、“ii”、“iii”或“iv”)
②104Pa、500℃时,主反应用平衡分压代替平黄浓度表示的化学平衡常数Kp=______(已知:气体分压=气体总压×体积分数)
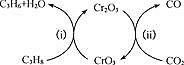
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图
已知:CO和H2的燃烧热分别为H=-283.0kJ·mol-1、H=-285.8kJ·mol-1
①图中催化剂为___________。
②298K时,该工艺总反应的热化学方程式为____________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是____________。
【答案】增大 副反应的活化能低于主反应的活化能 ⅰ 3.3×103Pa CrO3 C3H8(g)+CO2C3H6(g)+CO(g)+H2O(l) △H =+121.5kJ/mol 碳与CO2反应生成CO,脱离催化剂表面
【解析】
(1)①反应温度升高,平衡向正反应方向移动;
②由图可知,副反应的活化能低于主反应的活化能;
(2)①丙烷脱氢制丙烯为气体体积增大的反应;
②由题意建立三段式,结合公式计算分压常数;
(3)①由图可知,CrO3为催化剂;
②由盖斯定律计算可得;
③该工艺中碳与CO2反应生成CO。
(1)①由图可知,丙烷脱氢制丙烯为吸热反应:C3H8(g)C3H6(g)+H2(g) △H =+124.3 kJ/mol,恒压时若向原料气中掺入水蒸气,体系温度升高,平衡向正反应方向移动,化学平衡常数K增大,故答案为增大;
②由图可知,副反应的活化能低于主反应的活化能,温度升高,活化能较低的副反应更容易发生,故答案为副反应的活化能低于主反应的活化能;
(2)①丙烷脱氢制丙烯为气体体积增大的反应,增大压强,平衡向逆反应方向移动,丙烯的平衡体积分数减小;该反应为吸热反应,温度升高,平衡向正反应方向移动,故曲线ⅰ代表104 Pa时丙烯的平衡体积分数,故答案为ⅰ;
②104 Pa、500 ℃时,丙烯的平衡体积分数为33%,设起始丙烷为1mol,转化率为x,由题意建立如下三段式:
C3H8(g)C3H6(g)+H2(g)
起(mol) 1 0 0
变(mol) x x x
平(mol) 1-x x x
则由丙烯的平衡体积分数为33%可得,x/(1+x)=0.33,解得x≈0.5,丙烷、丙烯和氢气的分压均为104Pa×1/3,则用平衡分压代替平衡浓度表示的化学平衡常数Kp=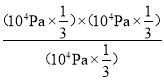 =104Pa×
=104Pa×![]() =3.3×103Pa,故答案为3.3×103Pa;
=3.3×103Pa,故答案为3.3×103Pa;
(3)①由图可知,反应ⅰ为3C3H8+2CrO33C3H6+Cr2O3+3H2O,反应ⅱ为3CO2+Cr2O32CrO3+3CO,则催化剂为CrO3,故答案为CrO3;
②由题意可得H2(g)+1/2O2(g)=H2O(l) △H =-285.8kJ/mol①CO(g)+1/2O2(g)=CO2 (g) △H =-283.0kJ/mol②C3H8(g)C3H6(g)+H2(g)△H =+124.3 kJ/mol③,由盖斯定律③-②+①得热化学方程式C3H8(g)+CO2C3H6(g)+CO(g)+H2O(l),则△H =(+124.3 kJ/mol)+(-285.8kJ/mol)-(-283.0kJ/mol)=+121.5kJ/mol,故答案为C3H8(g)+CO2C3H6(g)+CO(g)+H2O(l) △H =+121.5kJ/mol;
③该工艺中碳与CO2反应生成CO,可以有效消除催化剂表面的积炭,维持催化剂活性,故答案为碳与CO2反应生成CO,脱离催化剂表面。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol甲醇分子中含有的共价键数为4NA
B.2.4 g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5NA
D.1 L 0.5 mol/L CH3COONa溶液中含有的CH3COO-数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,对应离子一定能大量共存的是
A.在0.1mol/LNa2CO3溶液中:Al3+、![]() 、
、![]() 、
、![]()
B.pH=7的溶液中:Fe3+、Cl-、Na+、![]()
C.使甲基橙变红的溶液中:![]() 、Cl-、
、Cl-、![]() 、Mg2+
、Mg2+
D.25℃时,水电离出的 c(H+)=1×l0-13 mol/L的溶液中:K+、Ba2+、![]() 、S2-
、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有 CoO(OH)、CoCO3、Cu2(OH)2CO3 和 SiO2,及一定量的 Fe2O3、MgO 和CaO等。由该矿石制Co2O3的部分工艺流程如图:
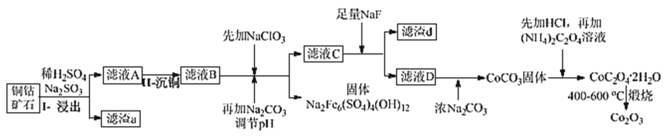
(1)在“浸出”过程中可以提高反应速率的方法有__。(写出两种即可)
(2)在“II-沉铜”过程中加入了FeS固体,得到更难溶的CuS,写出该步反应的离子方程式__。
(3)NaClO3 的主要作用是__。
(4)滤渣d 的主要成分是__。
(5)滤液D 中加入浓Na2CO3 后又加入HCl 溶解,其目的是__。
(6)写出CoC2O4·2H2O 在空气中煅烧得到 Co2O3 的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
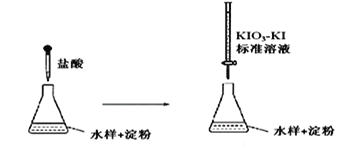
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
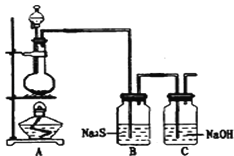
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁是合成锂离子电池正极材料磷酸亚铁锂的原料。某工厂以炼钢厂的脱硫渣(主要成分是Fe2O3)为原料生产电池级草酸亚铁晶体的工艺流程如下:
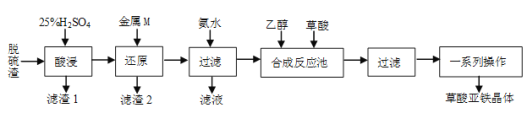
(1)要提高“酸浸”速率,宜采取的措施有___(填两条)。
(2)写出“还原”过程中既是化合反应又是氧化还原反应的离子方程式___。
(3)滤渣2中含有的TiOSO4在热水中易水解,生成H2TiO3,该反应的化学方程式为___。
(4)“滤液”经处理后得到一种化肥,其化学式为___。“一系列操作”指___。
(5)已知:298K时,Ksp[Fe(OH)2]=4.0×10-17,当离子浓度≤1.0×10-5molL-1时,视该离子已完全沉淀。上述流程中,加“氨水”调pH的范围为___(lg2≈0.3)。
(6)草酸亚铁晶体(FeC2O42H2O)纯度的测定:准确称取mg草酸亚铁晶体于锥形瓶中,加入一定量的稀硫酸溶液,并加热至50℃,用cmolL-1KMnO4标准溶液滴定,达到滴定终点时,用去标准溶液VmL。滴定反应(未配平):FeC2O42H2O+KMnO4+H2SO4→Fe2(SO4)3+CO2+MnSO4+K2SO4+H2O;则样品中FeC2O42H2O的纯度为___%(用含有m、c、V的代数式表示);若草酸亚铁晶体失去部分结晶水,测得的结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的恒温、恒压密闭容器中加入2mol X和2mol Y,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) ![]() a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a = _________________;
(2)平衡时Y的转化率=________________
(3)X的状态为______________,Y的状态为______________(填“气态”或“非气态”)
(4)下列叙述中,能说明上述反应达到平衡状态的是____________(填编号)
a.气体密度不变 b.单位时间内消耗2mol X,同时生成amol Z
c.Y的转化率不再变化 d.Z的浓度不再变化
e.气体的质量不随时间的变化而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com