
【题目】已知短周期元素的离子aA3+、bB+、cC2-、dD- 都具有相同的电子层结构 ,则下列叙述中正确的是 ( )
A. 原子半径:A>B>D>C B. 原子序数:d>c>b>a
C. 离子半径:C>D>B>A D. 单质的还原性:A>B>D>C
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
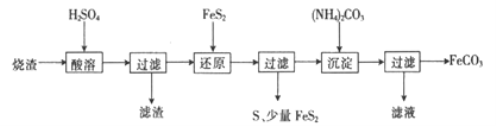
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1814年戴维发现了一氯化碘(沸点97.4℃),是一种红棕色易挥发液体,它的性质与卤素相似,可用作强氧化剂。干燥的氯气与碘反应可以制备ICl ,请用下列装置来制备ICl。

回答下列问题:
(1)制备ICl时,各装置接口的连接顺序是__________。
(2)能否将装置B 中的饱和食盐水换成水______(填“能”或“不能“);请用平衡移动的观点解释其理由________________。
(3)D装置中的烧瓶需放在冷水中,其目的是____________。
(4)将D装置得到的液态产物进步提纯可得到较纯净的IC1,提纯采取的方法是___________。
(5)ICl 与冷的NaOH稀溶液反应的离子方程式为______________。
(6)请设计实验证明IC1的氧化性比I2强:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是

A. 操作①中玻璃棒的作用是加快固体溶解速度
B. 操作②的操作名称是过滤
C. 操作③中盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图示. 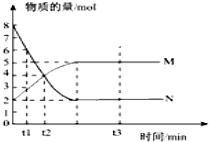
(1)此反应的化学方程式中a:b=
(2)t1到t2时刻,以M的浓度变化表示的平均化学反应速率为
(3)此反应在该条件下达到限度时,反应物的转化率为
(4)下列叙述中能说明上述反应达到平衡状态的是 A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗amol N,同时生成bmol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解产物,某学生设计了如下实验方案: 
回答下列问题:
(1)试剂1是 , 作用是;
(2)试剂2是 , 作用是 , 发生的离子反应为:; 如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的 , 若不能,其原因是 .
(3)如何检验第①步实验已基本完成 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应X+2Y=X2++2Y-的叙述中正确的是
A. X被氧化,Y是氧化剂 B. Y被还原,X是氧化剂,
C. X是还原剂,Y被氧化 D. Y被还原,X2+是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 , 其离子的原子结构示意图为
(2)写出⑤和⑨最高价氧化物对应水化物间发生反应的离子方程式: .
(3)按要求写出下列两种物质的电子式:①的单质;⑨的过氧化物;
(4)在⑦与⑩的单质中,化学性质较活泼的是 , 可用什么化学反应说明该事实(写出反应的化学方程式): .
(5)请用电子式表示④和⑩组成的化合物的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。
(1)实验室制备原料气NO和Cl2的装置如下图所示:
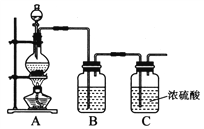
实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_______。装置B中盛放的试剂为_______,其作用为___________________。
(2)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_______。
②装置D中发生的反应方程式为__________________。
③如果不用装置E会引起什么后果______________________。
④某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____,为了充分吸收尾气,可将尾气与_______同时通入氢氧化钠溶液中。
(3)工业上可用间接电化学法除去NO,其原理如下图所示,吸收塔中发生的反应为:NO+S2O42+H2O→N2+HSO3

①吸收塔内发生反应的氧化剂与还原剂物质的量之比为_________________。
②阴极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com