
【题目】某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+和Fe3+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:

则下列说法正确的是
A. 若含有Fe3+,则一定含有Cl-
B. SO42-、NH4+一定存在,Fe2+和Fe3+可能都存在
C. 该溶液中只存在上述离子中的NO3-、SO42-、NH4+、Fe2+四种离子
D. 气体甲能使湿润的蓝色石蕊试纸变红
【答案】C
【解析】
某溶液X中加入稀硫酸产生气体乙,发生的反应可能是CO32-与H+的反应,也可能是NO3-在H+存在条件下与Fe2+的氧化还原反应;溶液加入过量的氢氧化钠,产生0.02mol气体甲,故溶液中含有NH4+,气体甲是氨气;加入氢氧化钠产生沉淀甲,故溶液中含有Fe2+或Fe3+或两者均有;反应后溶液继续添加氯化钡产生沉淀,故溶液中含有SO42-,沉淀乙为硫酸钡; 根据电荷守恒和题目中要求所含阴离子的物质的量相等,计算具体离子含量,确定NO3-、Cl-存在。
由上述分析可知,产生气体甲0.02mol,则铵根物质的量为0.02mol;产生沉淀乙4.66g,则硫酸根物质的量为0.02mol;沉淀甲为氢氧化铁或氢氧化亚铁或两者均有,经过灼烧后,产物为氧化铁,物质的量为0.01mol,故溶液X中含Fe2+或Fe3+或两者均有,且物质的量一定为0.02mol,由于Fe2+或Fe3+均能与CO32-发生双水解而不能共存,故溶液中无CO32-,则生成气体乙的反应只能是NO3-与Fe2+的氧化还原反应,故溶液中一定含Fe2+和NO3-,而所含阴离子的物质的量相等,即NO3-的物质的量也为0.02mol;
故现在溶液X中已经确定存在的离子是——阴离子:0.02molNO3-,0.02molSO42-,共带0.06mol负电荷;阳离子:0.02molNH4+,0.02molFe2+或Fe2+、Fe3+的混合物,所带的正电荷≥0.06mol,一定不含CO32-。
根据溶液呈电中性可知,当 0.02mol全部是Fe2+时,阳离子所带正电荷为0.06mol,则Cl-不存在;若溶液中含Fe3+,必须存在 Cl-,且物质的量为0.02mol,不符合电中性。
A. 若含有Fe3+,则一定含有Cl-,根据阴离子物质的量相同的条件,氯离子物质的量为0.02mol,无法保持电中性,A错误;
B. SO42-、NH4+ 、Fe2+一定存在,Fe3+一定不存在,B错误;
C. 该溶液中只存在上述离子中的NO3-、SO42-、NH4+、Fe2+四种离子,C正确;
D. 气体甲是氨气,能使湿润的红色石蕊试纸变蓝,D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】如图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框中的字母表示一种反应物或生成物(部分物质,反应条件已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
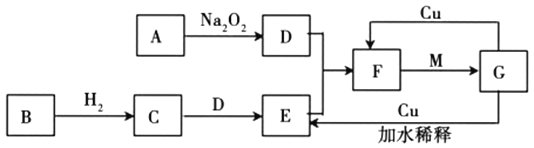
(1)写出![]() 的化学方程式:_______________________。
的化学方程式:_______________________。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为_________,干燥C常用_______________(填写试剂名称)。
(3)E物质遇到D物质时,会观察到_______________________现象,若用排水法收集F,则最终集气瓶中收集到的气体为____________________(写化学式)。
(4)写出![]() 的离子反应方程式_________________________。
的离子反应方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.将FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.水解反应NH4++H2O![]() NH3H2O+H+达到平衡后,升高温度平衡逆向移动
NH3H2O+H+达到平衡后,升高温度平衡逆向移动
C.CH3COONa溶液中加入CH3COOH能促进CH3COO-水解
D.常温下,浓度均为0.1molL-1 NaCN和HCN混合液的pH=9,则c(HCN)>c(Na+)>c(CN﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.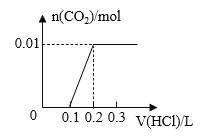 B.
B.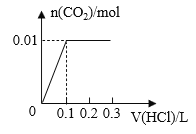
C.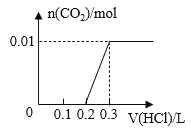 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铝[(1x)Al2(SO4)3·xAl(OH)3]溶液可用于烟气脱硫。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝溶液,实验流程如下:
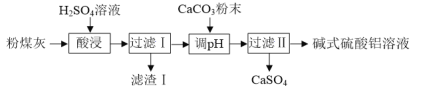
已知“调pH”的反应为:(2x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
(1)“酸浸”时反应的化学方程式为____。
(2)“酸浸”时适当增大H2SO4溶液浓度的目的是____,能达到相同目的的方法还有____(任写一种)。
(3)“酸浸”时应控制H2SO4溶液的用量,H2SO4溶液用量不能过量太多的原因是____。
(4)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,加入0.1000 mol·L1 EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列各题:
(1)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为___________。P形成的三种酸的酸性由强到弱的顺序为:HPO3>H3PO4>H3PO3,原因是___________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子价电子排布式为___________________,Q2+的未成对电子数是______________。
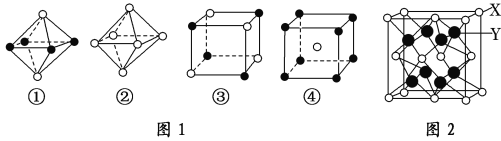
(3)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图是图1中的______________。
(4)[Cu(NH3)4]2+配离子中存在的化学键类型有_____________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为______________(填序号)
①平面正方形 ②正四面体 ③三角锥形 ④V形
(6)X与Y可形成离子化合物,其晶胞结构如图2所示,其中X和Y的相对原子质量分别为a和b,NA表示阿伏加德罗常数,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是_____________pm(用含ρ、a、b、NA的代数式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
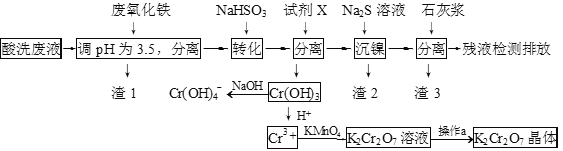
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
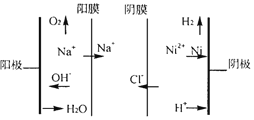
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com