
�±����г���25�桢101kPaʱһЩ���ʵ�ȼ��������
| ���� | CH4 | C2H2 | H2 |
| ȼ���ȣ�kJ��mol��l | 890.3 | 1299.6 | 285.8 |
��֪���ܣ�C��H����413.4 kJ��mol��1��H��H����436.0 kJ��mol��1��������������ȷ����
A��C��C����Ϊ796.0 kJ��mol��1 B��C��H������С��H��H��
C��2H2(g)+O2(g)=2H2O(g) ��H=��571.6 kJ��mol��1
D��2CH4(g)=C2H2(g) +3H2(g) ��H=��376.4 kJ��mol��1
��֪ʶ�㡿��ѧ��Ӧ���������Ȼ�ѧ����ʽ
���𰸽����� A ��������Ȳȼ���ȵ��Ȼ�ѧ����ʽ��
C2H2��g��+5/2O2��g���T2CO2��g��+H2O��l����H=-1299.6 kJ/mol��
����ȼ���ȵ��Ȼ�ѧ����ʽ��‚CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-890.3KJ/mol
����ȼ���ȵ��Ȼ�ѧ����ʽ��ƒH2��g��+1/2O2��g��=H2O��1����H=-285.8kJ•mol-1
��˹���ɣ�2��‚--3��ƒ�ã�2CH4=C2H2+3H2 ��H=376.4kJ•mol-1 �� ��8��413.4-
��E��C��C��+2��413.4+3��436��=376.4�����E��C��C��=796.0����A��ȷ��B������Խ��ѧ��Խ�ȶ�������ԽС��C��H����������H��H������B����C������ʽ��ˮ�ľۼ�״̬Ӧ����Һ̬����C����D������������֪����Ӧ������ֵ����D����
�ʴ�ѡA
��˼·�㲦��������һ�����ڻ�ѧ��Ӧ�е������仯����Ŀ�����Ը�����ѧ֪ʶ���лش�
�ѶȲ���Ҫע��������ݻ�ý�����Ϣ���Ȼ�ѧ����ʽ��дҪע��ˮ��״̬��Ϊ�״��㡣


 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1��������������Ĺ�����������Ӧ����������������� ��������CH3CH2OH��CH3CHO��Ӧѡ�á�B��������ĸ����
A��NaOH��Һ B��������Һ C������
�������� ��
�� Ӧѡ�á�A�� ������ĸ����
Ӧѡ�á�A�� ������ĸ����
A��KMnO4��Һ B����ˮ C��Na2CO3��Һ
�������� ��
�� Ӧѡ�á�C�� ������ĸ����
Ӧѡ�á�C�� ������ĸ����
A��AgNO3��Һ B��NaOH��Һ C��FeCl3��Һ
��2�����л���ѧ�У�ͬ���칹���ձ�������� ����ʽΪC4H9Br���л��ﹲ�С�4���ֲ�ͬ�ṹ�����У�һ���л���ͨ����ȥ��Ӧ��ת��Ϊ2����ϩ����д������ȥ��Ӧ�Ļ�ѧ����ʽ��CH3CH2CHBrCH3 CH3CH=CHCH3+H2O������һ���л���ĺ˴Ź�������ͼ����ʾֻ��һ���壬��д�����л���Ľṹ��ʽ����
CH3CH=CHCH3+H2O������һ���л���ĺ˴Ź�������ͼ����ʾֻ��һ���壬��д�����л���Ľṹ��ʽ���� ����
����
��3���۶������Ҷ�������PES����һ������ɽ���ľ������������ϱ�Ĥ��ʳƷ��װ��������Ϸ������Ź㷺��Ӧ�ã���ṹ��ʽ���£�

�پ۶������Ҷ�������PES���������ֵ���ͨ�������ۡ���Ӧ���Ӧ���ͣ��Ƶõģ��γɸþۺ�������ֵ����ǡ�HOOCCH2CH2COOH���͡�HOCH2CH2OH����
�������ֵ����֮��Ҳ�����γ�һ�ְ�Ԫ��״������д���û�״������Ľṹ��ʽ���� ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£�ij�ܱ������еķ�ӦΪ��aX��g��+bY��g��)  cZ��g��+dW��g������5min�ﵽƽ�⣬X����n mol/L��Y����n/3mol/L��Z����2n/3mol/L��������ϵѹǿ����W�İٷֺ����������仯����
cZ��g��+dW��g������5min�ﵽƽ�⣬X����n mol/L��Y����n/3mol/L��Z����2n/3mol/L��������ϵѹǿ����W�İٷֺ����������仯����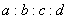 Ϊ
Ϊ
A��3:1:2:1 B��1:3:2:2 C��1:3:1:2 D��3:1:2:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ�鲻�ܴﵽԤ��ʵ��Ŀ�ĵ���
| ѡ�� | ʵ������ | ʵ��Ŀ�� |
| A | ��2.5 g CuSO4��5H2O�ܽ���97.5 g ˮ�� | ������������Ϊ1.6%��CuSO4��Һ |
| B | ��ʢ��1 mL��������Һ���Թ��еμ�NaCl��Һ���������г������ɣ��������еμ�Na2S��Һ | ˵��һ�ֳ�����ת��Ϊ��һ���ܽ�ȸ�С�ij��� |
| C | ȡ���������������ˮ�У��μ�����Ba(OH)2��Һ���۲��Ƿ��а�ɫ�������� | ����NaHCO3�������Ƿ�Na2CO3 |
| D | ȡ����Һ©����������ϲ�Һ�� | �²�Һ��ӷ�Һ©���¶˹ܿڷų����رջ�������һ�������������ϲ�Һ��ӷ�Һ©���Ͽڵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ����ᡢ���������������ء�����˵����ȷ����
A��ʯӢֻ�������������ά
B���Ӻ�ˮ��ȡ���ʶ�����ͨ����ѧ��Ӧ����ʵ��
C��Ϊ������ʳ���Ӫ���ɷ֣����Դ���ʹ��ʳƷ���Ӽ�
D�����ۡ���ά�غ�֬����һ�������¶����Է���ˮ�ⷴӦ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������A(H3BNH3)��һ��DZ�ڵĴ�����ϣ�������Ԫ��״����(HB=NH)3ͨ����Ӧ3CH4+2(HB=NH)3+6H2O��3CO2+6H3BNH3�Ƶá�A��һ��������ͨ���ಽȥ�������ת��Ϊ������BN������ش�
��1����(HB=NH)3��Ϊ�ȵ�����ķ���Ϊ (�����ʽ)��
��2�����й��ںϳ�A�Ļ�ѧ����ʽ����������ȷ���� (��ѡ����ĸ)��
a����Ӧǰ��̼ԭ�ӵĹ���ӻ����Ͳ���
b��CH4��H2O��CO2�ķ��ӿռ乹�ͷֱ�Ϊ���������Ρ�V�Ρ�ֱ����
c����һ�����ܵĴ�С��ϵΪ��N>O>C>B
d��A�д�����λ��
��3��������(BN)�ж��־��ͣ�������������������ʯ�Ĺ������ƣ����侧���й���
����ԭ�ӣ� ����ԭ�ӡ�
��4���˹����Ժϳ����һϵ�е�����������������������ƣ��ʳ�֮Ϊ���顣��ҵ�ϲ���LiAlH4��BF3�������ѽ����з�Ӧ�Ƶ�������(B2H6) ,ͬʱ�����������ֲ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
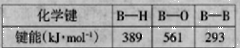 ��5����ػ�ѧ���ļ������±���ʾ����Ҫ�����ͽ���������ʵ��
��5����ػ�ѧ���ļ������±���ʾ����Ҫ�����ͽ���������ʵ��
��Ȼ���в��������ʣ����⻯��Ҳ���٣���Ҫ�Ǻ��������ԭ��Ϊ
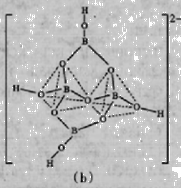 ��6�����������У�����������״����״���Ǽ�״�ȶ��ֽ�
��6�����������У�����������״����״���Ǽ�״�ȶ��ֽ�
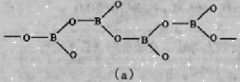
����ʽ��ͼ(a)Ϊһ����������״�ṹ�Ķ��������
�仯ѧʽΪ ��ͼ(b)Ϊ��ɰ�����е���
���ӣ�������ԭ�Ӳ�ȡ���ӻ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Na2O2��HCl��Al2O3����������ˮ����ȫ��Ӧ��,��Һ��ֻ����Na+��H+��Cl����OH������Һ������,��Na2O2��HCl��Al2O3�����ʵ���֮�ȿ���Ϊ
A��3��2��1 B��2��4��1 C��2��3��1 D��4��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и���������ָ����Һ���ܴ���������� �� ��
����ɫ��Һ�У�K+��Na+��MnO4����SO42��
��pH=11����Һ�У�CO32����Na+��AlO2����NO3��
 �ۼ���Al�ܷų�H2����Һ�У�Cl����HCO3����SO42����NH4+
�ۼ���Al�ܷų�H2����Һ�У�Cl����HCO3����SO42����NH4+
����ˮ�������c(OH��)=10��13mol��L��1����Һ�У�Na+��Ba2+��Cl����Br��
���н϶�Fe3+����Һ�У� Na+��NH4+��SCN����HCO3��
��������Һ�У�Fe2+��Al3+��NO3����I����Cl��
A���٢� ���� B���ۢޡ��� C���ڢܡ� ��D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�𰸡�(1)0.1 mol��L��1��min��1��0.166 7���� (2)�����¶ȡ�(3)71.88%
�������£����Ϊ1 L���ܱ������з������·�Ӧ��
SiF4(g)��2H2O(g)  SiO2(s)��4HF(g) ��H����148.9 kJ��mol��1
SiO2(s)��4HF(g) ��H����148.9 kJ��mol��1
(1)���и�������˵���÷�Ӧ�Ѵﻯѧƽ��״̬����________(����ĸ���)��
a��v����(SiF4)��4v����(HF) b������������ѹǿ���ٱ仯
c����������������������ٱ仯 d��HF������������ٱ仯
(2)��Ӧ�����вⶨ�IJ����������±�(����t2��t1)��ʾ��
| ��Ӧʱ��/min | n(SiF4)/mol | n(H2O)/mo |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
ͨ��a��b��ֵ����ѧƽ��ԭ��˵��t1ʱ��Ӧ�Ƿ�ﵽ��ѧƽ��״̬��_________________________________________________________________________��
(3)��ֻ�ı�һ������ʹ������Ӧ�Ļ�ѧƽ�ⳣ����÷�Ӧ________(�����)��
a��һ��������Ӧ�����ƶ� b��һ�����淴Ӧ�����ƶ�
c��һ���Ǽ�Сѹǿ��ɵ� d��һ���������¶���ɵ� e��SiF4��ƽ��ת����һ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com