
【题目】如图中,两电极上发生的电极反应如下:a极:![]() ↑,b极:
↑,b极:![]() -2
-2![]() =
=![]() 。则以下说法不正确的是( )
。则以下说法不正确的是( )
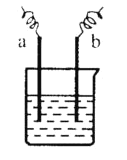
A.该装置可能是电解池
B.该装置中电解质溶液pH可能等于7
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在800 mL的大烧杯中放入碎纸屑把盛有50 mL 0.50 mol·L-1盐酸的100 mL烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑料板做成大烧杯盖,通过盖子插入一根环形玻璃搅拌棒和一支温度计,测定溶液的温度。迅速往盐酸中加入 50 mL 0.55 mol·L-1NaOH溶液,盖好盖子,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装有反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。
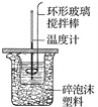
(1)烧杯间填满碎纸屑的作用是____________。
(2)要重复进行三次实验的目的是_____________。
(3)烧杯若不盖泡沫塑料板,求得的中和热数值将________(填“偏大”“偏小”或“无影响”)。
(4)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1NaOH溶液进行上述反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),理由是_______。
(5)三次实验测得的数据中,起始时盐酸与NaOH溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.5 ℃。则最终代入计算式的温度差的平均值为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计如下实验。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100℃时开始升华,157℃时大量升华并开始分解;草酸蒸气在低温下迅速冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:

①装置的连接顺序为:A→D→____→____→F→E→C→G。
②装置中冰水混合物的作用是____。
③整套装置存在不合理之处为____。
Ⅱ.乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol/L的草酸溶液480mL。
(2)配制该溶液需要草酸晶体____g。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是____。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1mol/L草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
D.测定草酸钠溶液的pH
(4)该小组同学将0.1mol/L草酸溶液和0.1mol/L的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为____。
Ⅲ.乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯下列物质(括号内物质为杂质)。实验操作合理的是( )
A.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出
B.苯(苯酚):加入足量浓溴水,充分振荡.静置后分液
C.![]() :通人盛有
:通人盛有![]() 溶液的洗气瓶
溶液的洗气瓶
D.![]() [
[![]() ]:放入水中调成浆状,加入足量
]:放入水中调成浆状,加入足量![]() 溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-====4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2====2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有甲、乙两种成分:
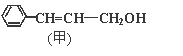
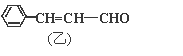
(1)①乙中含氧官能团的名称分别为_______。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式_______。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物):
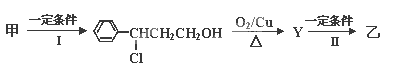
反应I的反应类型为______,Y的结构简式_______。
(3)1mol乙最多可与______molH2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“诺龙”属于国际奥委会明确规定的违禁药品类固醇,其结构简式如下图所示。下列关于“诺龙”的说法中,不正确的是
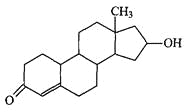
A.分子式是C18H26O2
B.既能发生加成反应,也能发生酯化反应
C.能在NaOH醇溶液中发生消去反应
D.既能发生氧化反应,也能发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com