
分析 ①作为相对原子质量标准的核素为12C;
②根据中子数=质量数-质子数计算;根据原子质量之比等于质量数之比;
③硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,再根据M=$\frac{m}{n}$计算其物质的量之比,利用物质的量计算其质量百分比;
④反应方程式:K35ClO3+6H37Cl=K37Cl+Cl2↑+3H2O生成的Cl2中,35Cl与37Cl个数比为1:5,然后根据摩尔质量与相对分子质量在数值上相等求解.
解答 解:①国际上一致以12C原子质量的$\frac{1}{12}$作为标准来衡量各种原子的相对原子质量;
故答案为:12C;
②${\;}_{53}^{115}$I的质子数为53,质量数为115,中子数=115-53=72,根据原子质量之比等于质量数之比可知,该原子的质量是上述碳原子质量的$\frac{125}{12}$倍;
故答案为:72;$\frac{125}{12}$;
③硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,
设10B和11B的物质的量分别是xmol、ymol,则$\frac{10g/mol×xmol+11g/mol×ymol}{(x+y)mol}$=10.8g/mol,
解得:x:y=1:4,设10B和11B的物质的量分别是1mol、4mol,
则115B的质量百分比是$\frac{4mol×11g/mol}{4mol×11g/mol+1mol×10g/mol}$×100%≈81.5%;
故答案为:81.5%;
④反应方程式:K35ClO3+6H37Cl=K37Cl+Cl2↑+3H2O生成的Cl2中,35Cl与37Cl个数比为1:5,35Cl与37Cl个数比为1:5,生成的氯气相对分子质量约为$\frac{37×5+35}{3}$=73.3;
故答案为:73.3;
点评 本题考查同位素的应用、原子的构成及相对原子质量的计算,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
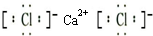 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 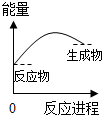 | B. | 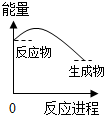 | C. | 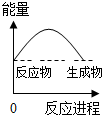 | D. | 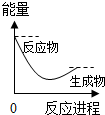 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
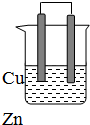 由铜、锌和稀硫酸组成的原电池中:
由铜、锌和稀硫酸组成的原电池中: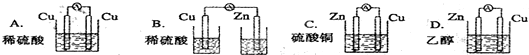
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA是一种强酸 | B. | 反应后溶液中c(OH-)<c(H+) | ||
| C. | c(A-)>c(B+)>c(H+)>c(OH-) | D. | 反应后混合溶液中还含有HA分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③④⑥ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
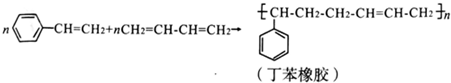
| A. | 丁苯橡胶的两种单体都属于烃 | B. | 丁苯橡胶不能使溴水褪色 | ||
| C. | 上述反应的原子利用率为100% | D. | 丁苯橡胶属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com