
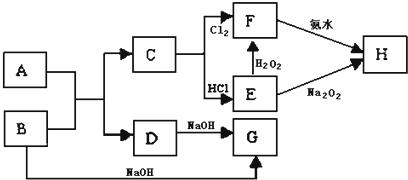
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
A、蒸馏实验时,蒸馏烧瓶中盛有约
| ||
| B、蒸馏实验时,将温度计的水银球插入液体中 | ||
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | ||
| D、蒸发操作时,应使混合物中剩有少量水份时即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的醋酸溶液稀释100倍,pH=5 |
| B、pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol?L-1 |
| C、将1L 0.1mol?L-1的Ba(OH)2溶液稀释为2L,pH=13 |
| D、pH=8的NaOH溶液稀释100倍,其pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
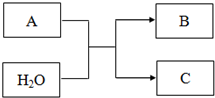 A、B、C均为短周期元素组成的物质,其转化关系如下:
A、B、C均为短周期元素组成的物质,其转化关系如下:查看答案和解析>>
科目:高中化学 来源: 题型:
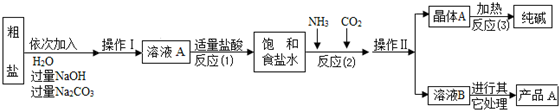
| 选择的装置 (填编号) |
实验现象 | 实验结论 |
| 样品不含晶体A |

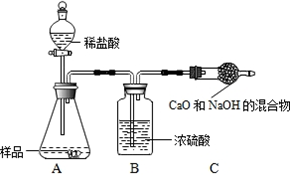
查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.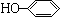 )的电离平衡常数K2的相对大小
)的电离平衡常数K2的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
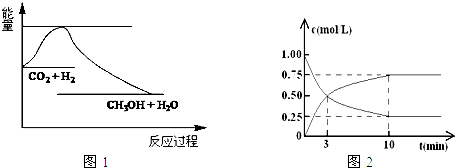
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com