
【题目】如图表示一个化学反应过程,图中的黑球表示两个相同的单糖或其单元。
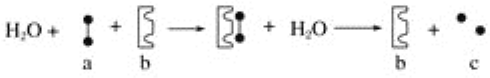
则图中的a、b、c分别表示( )
A. 麦芽糖 麦芽糖酶 葡萄糖
B. 蔗糖 蔗糖酶 果糖
C. 乳糖 乳糖酶 葡萄糖
D. 淀粉 淀粉酶 葡萄糖
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
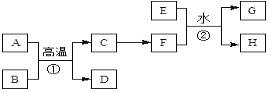
请回答下列问题:
(1)D的化学式是____。
(2)可选用____(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为____。
(4)反应②的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g)+O2(g)![]() -2NO2(g)△H的反应历程分两步:
-2NO2(g)△H的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+ O2(g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1__E2(填“>”、“<”或“=”) 其判断理由是__________;2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、k2逆分别增大a倍和b倍,则a____b(填“>”、“<”或“=”);一定条件下,2NO(g)+O2(g)
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、k2逆分别增大a倍和b倍,则a____b(填“>”、“<”或“=”);一定条件下,2NO(g)+O2(g) ![]() 2NO2(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO):n(O2) =2:1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。

②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):

2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→+O2-+1/2O2+V。______________
(3)电解NO可制备NH4NO3,其工作原理如右图所示,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒的化合物常用于制作催化剂和新型电池。回答下列问题:
(1)金属钒可由铝热反应制得。已知25℃、101 kPa时,
4A1(s)+3O2(g)=2Al2O3 (s) △H1=a kJ·mol-1
4V(s) +5O2 (g)=2V2O5(s) △H2=b kJ·mol-1
则用铝热反应冶炼金属V(s)的热化学方程式为_____________________。
⑵V2O5为橙黄至砖红色固体,无味、有毒,微溶于水,是许多有机和无机反应的催化剂。下图表示的是25℃时,部分含钒微粒的存在形式、浓度和存在的pH范围(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未准确确定。
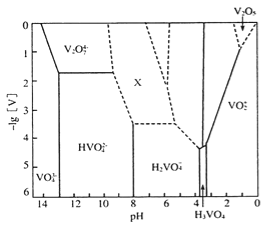
①V2O5溶于足量2mol L-1NaOH溶液中,发生反应的离子方程式为_________________,向反应后的溶液中,滴加硫酸溶液至过量(pH<1)的过程中,开始溶液保持澄淸,滴加一段时间后,观察到有橙黄色沉淀产生,继续滴加硫酸溶液,沉淀又消失。则沉淀消失过程中发生反应的化学方程式为_______________。
②上述滴加硫酸溶液的过程中,先后发生如下反应:

则“X所示区域溶液中的离子”不可能是___________(填序号);
a.V3O93- b.V4O103- c. V4O124-
(3)V2O5是反应2SO2+O2![]() 2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
(4)下图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_____________(填“增大”、“减小”或“不变”),电池充电时,阳极的电极反应式为_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是( )
A.用分液的方法分离水和酒精的混合物
B.进行分液时,分液漏斗中的上层液体上口倒出,下层液体下口流出
C.配制NaCl溶液时可用托盘天平称量5.85gNaCl固体
D.用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某同学利用下列实验探究金属铝与铜盐溶液反应:

下列说法正确的是
A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜
B. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
C. 实验2中生成红色物质的离子方程式:Al+Cu2+→Al3++Cu
D. 由上述实验可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol/L的盐酸和硫酸反应,后者更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实验探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及实验现象如图所示,结合实验现象判断,该同学得出的下列结论中正确的是( )

A.向滤液中滴加盐酸的实验现象是产生白色沉淀
B.滤渣可能是两种金属单质的混合物
C.滤渣在足量的稀硝酸中能完全溶解
D.加入的金属M可能是镁或钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有 Na2CO3、NaHCO3 和 NaCl 中的一种或多种。下列根据实验事实 得出的结论正确的是
A. 取一定量固体,溶解,向溶液中加入适量 CaO 粉末,充分反应后观察到有白色沉淀生成,说 明原固体中一定含有 Na2CO3
B. 取一定量固体,溶解,向溶液中通入足量的 CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
C. 取一定量固体,溶解,向溶液中滴加适量 AgNO3 溶液,观察到有白色沉淀生成,说明原固体 中一定含有 NaCl
D. 称取 4.75 g 固体,加热至恒重,质量减少了 0.930 g。用足量稀盐酸溶解残留固体,充分反应 后,收集到 1.10 g 气体,说明原固体中含有 Na2CO3、NaHCO3 和 NaCl 三种,且它们的物质的 量之比为 1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的H2SO4溶液中,分别滴入物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示,下列分析不正确的是

A. ①代表滴加Ba(OH)2溶液的变化曲线 B. a、c两点,溶液中均大量存在H+和SO42-
C. b、d两点对应的溶液均显中性 D. e点,两溶液中含有相同量的OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com