
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g)+O2(g)![]() -2NO2(g)△H的反应历程分两步:
-2NO2(g)△H的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+ O2(g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1__E2(填“>”、“<”或“=”) 其判断理由是__________;2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、k2逆分别增大a倍和b倍,则a____b(填“>”、“<”或“=”);一定条件下,2NO(g)+O2(g)
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、k2逆分别增大a倍和b倍,则a____b(填“>”、“<”或“=”);一定条件下,2NO(g)+O2(g) ![]() 2NO2(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO):n(O2) =2:1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。

②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):

2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→+O2-+1/2O2+V。______________
(3)电解NO可制备NH4NO3,其工作原理如右图所示,阴极的电极反应式为______________。
【答案】< 活化能越大,一般分子成为活化分子越难,反应速率越慢 k1正.k2正/(k1逆.k2逆) < 温度升高,反应①、②的平衡均逆移,由于反应①的速率大,导致c(N2O2)减小且其程度大于k2正和c(O2)增大的程度,使三者的乘积即v2正减小 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O 350℃、负载率3.0% 2Ni3+ + O2-→2Ni2+ +VO+1/2O2 NO + 6H+ +5e- = NH4+ + H2O
3N2+4CO2+4H2O 350℃、负载率3.0% 2Ni3+ + O2-→2Ni2+ +VO+1/2O2 NO + 6H+ +5e- = NH4+ + H2O
【解析】
(1)活化能越低,反应速率越快,反应达到化学平衡时,v正=v逆,由速率方程,反应速率常数k随温度升高而增大,反应②为放热反应,温度升高不利于反应正向进行,则v正<v逆,反应①为快反应,温度升高,两个反应均逆向移动,体系中c(N2O2)降低,影响v2正;(2)①由图分析,在Cu+催化作用下,C2H2作为还原剂,NO和O2转化为N2、CO2和H2O,写出反应方程式,由图象可知,需要满足脱销率尽可能大,负载率选择b,温度选择350℃;②整个反应机理过程需满足元素守恒,抓住主反应为2NO═N2+O2,其余都是中间体,整个反应过程中,各中间体需有产生、有消耗,使得三步反应机理净结果为2NO═N2+O2;(3)电解池阴极发生还原反应,NO被还原为NH4+,写出阴极的电极反应。
(1)活化能越低,反应速率越快,①为快反应,②为慢反应,则活化能大小为E1<E2,判断理由是:活化能越大,一般分子成为活化分子越难,反应速率越慢,2NO(g)+O2(g)![]() 2NO2(g) 的平衡常数K=c2(NO2)/c(O2)c2(NO),反应达到化学平衡时,v正=v逆,所以k1正c2(NO)=k1逆c2(N2O2),k2正c2(N2O2)·c(O2)=k2逆c2(NO2),则有k1正·k2正/k1逆·k2逆=
2NO2(g) 的平衡常数K=c2(NO2)/c(O2)c2(NO),反应达到化学平衡时,v正=v逆,所以k1正c2(NO)=k1逆c2(N2O2),k2正c2(N2O2)·c(O2)=k2逆c2(NO2),则有k1正·k2正/k1逆·k2逆=![]() =K,反应速率常数k随温度升高而增大,反应②为放热反应,温度升高不利于反应正向进行,则v正<v逆,所以若升高温度后k2正、k2逆分别增大a倍和b倍,则a<b,反应①为快反应,温度升高,两个反应均逆向移动,体系中c(N2O2)降低,影响v2正,导致v2正减小,可以解释为:温度升高,反应①、②的平衡均逆移,由于反应①的速率大,导致c(N2O2)减小且其程度大于k2正和c(O2)增大的程度,使三者的乘积即v2正减小;(2)①根据机理图分析,在Cu+催化作用下,C2H2作为还原剂,NO和O2转化为N2、CO2和H2O,反应中n(NO):n(O2)=2:1,所以发生反应的化学方程式为:6NO+3O2+2C2H4
=K,反应速率常数k随温度升高而增大,反应②为放热反应,温度升高不利于反应正向进行,则v正<v逆,所以若升高温度后k2正、k2逆分别增大a倍和b倍,则a<b,反应①为快反应,温度升高,两个反应均逆向移动,体系中c(N2O2)降低,影响v2正,导致v2正减小,可以解释为:温度升高,反应①、②的平衡均逆移,由于反应①的速率大,导致c(N2O2)减小且其程度大于k2正和c(O2)增大的程度,使三者的乘积即v2正减小;(2)①根据机理图分析,在Cu+催化作用下,C2H2作为还原剂,NO和O2转化为N2、CO2和H2O,反应中n(NO):n(O2)=2:1,所以发生反应的化学方程式为:6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O.根据图象分析,需要满足脱销率尽可能大,负载率选择b,温度选择350℃,即温度选择350℃,负载率选择3.0%;②整个反应机理过程需满足元素守恒,消耗氧空穴,最终还需生成氧空穴,整个反应机理为:①:①2Ni2++2VO+2NO→2Ni3++2O-+N2,②2O-→O2-+1/2O2+VO,第二步机理中释放了一个O原子和一个O2-,第一步反应消耗2个氧空穴,第一步反应Ni2+转化为Ni3+,则第三步反应机理中,Ni3+需转化为Ni2+,消耗O2-,再生成一个O原子和一个氧空穴,最终还得是生成N2和O2,抓住主要反应2NO═N2+O2,其余都是中间体,各中间体需限制在三步反应机理内有产生有消耗,最终使三步反应机理净结果为2NO═N2+O2,综合考虑,则第③步反应机理应为:2Ni3++O2-→2Ni2++VO+1/2O2;(3)电解池阴极发生还原反应,NO被还原为NH4+,所以阴极的电极反应为:NO+6H++5e-=NH4++H2O。
3N2+4CO2+4H2O.根据图象分析,需要满足脱销率尽可能大,负载率选择b,温度选择350℃,即温度选择350℃,负载率选择3.0%;②整个反应机理过程需满足元素守恒,消耗氧空穴,最终还需生成氧空穴,整个反应机理为:①:①2Ni2++2VO+2NO→2Ni3++2O-+N2,②2O-→O2-+1/2O2+VO,第二步机理中释放了一个O原子和一个O2-,第一步反应消耗2个氧空穴,第一步反应Ni2+转化为Ni3+,则第三步反应机理中,Ni3+需转化为Ni2+,消耗O2-,再生成一个O原子和一个氧空穴,最终还得是生成N2和O2,抓住主要反应2NO═N2+O2,其余都是中间体,各中间体需限制在三步反应机理内有产生有消耗,最终使三步反应机理净结果为2NO═N2+O2,综合考虑,则第③步反应机理应为:2Ni3++O2-→2Ni2++VO+1/2O2;(3)电解池阴极发生还原反应,NO被还原为NH4+,所以阴极的电极反应为:NO+6H++5e-=NH4++H2O。


科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
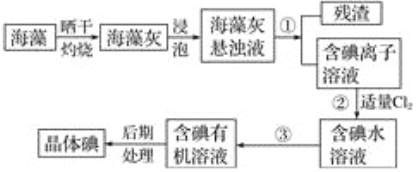
(1)实验室焙烧海带,需要下列仪器中的________(填字母)。
a.试管 b.烧杯c.坩埚 d.泥三角e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③________。
(3)提取碘的过程中,可选择的有机试剂是________(填字母)。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有________、________。
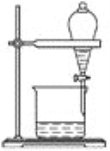
(5)小组用CCl4萃取碘水中的碘,在下图的分液漏斗中,下层液体呈________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_________________________________________。
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
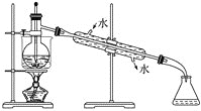
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(7)进行上述蒸馏操作时,使用水浴加热的原因是________________________________________________,最后晶态碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出),单质A常作为食品包装材料,甲是两性氧化物。
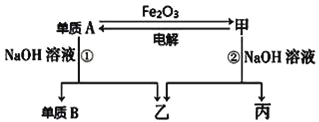
根据图示转化关系回答:
(1)写出反应①的离子方程式:_________________。
(2)实验室完成单质A与Fe2O3反应实验,需要的试剂还有_______。
a.KCl b.KClO 3 c.MnO2 d.Mg
(3)利用该反应的原理,工业上可用于___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如表提供的数据可知,在溶液中能大量共存的微粒组是

A. H2CO3 、HCO3-、CH3COO-、CN-
B. CO32-、 HCO3-、CH3COOH、CN-
C. HCO3-、CH3COO-、CN-、HCN
D. HCN 、HCO3-、CN-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1 mol A、2 mol B,此时甲、乙的容积均为2 L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:A(g)+2B(g)![]() 2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
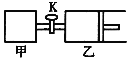
A. 甲中反应的平衡常数小于乙
B. 若打开活塞K,达平衡时乙容器的体积为3.2 L
C. 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态
D. 平衡时甲容器中A的物质的量小于0.55 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽然很少,却是维持正常生命活动不可缺少的。这可通过下面的哪一实例得到证实( )
A.缺Mg时叶片变黄
B.油菜缺B时只开花不结果
C.动物血液中钙盐的含量太低会抽搐
D.缺P会导致作物植株矮小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个化学反应过程,图中的黑球表示两个相同的单糖或其单元。
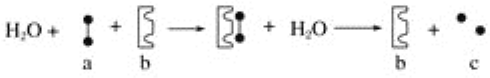
则图中的a、b、c分别表示( )
A. 麦芽糖 麦芽糖酶 葡萄糖
B. 蔗糖 蔗糖酶 果糖
C. 乳糖 乳糖酶 葡萄糖
D. 淀粉 淀粉酶 葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于组成生物体的化学元素的叙述,正确的是( )
A. 组成细胞的化学元素大多以化合物的形式存在
B. 细胞中常见的化学元素有60种
C. C元素是组成细胞的最基本元素,因为C元素含量最多
D. K、Ca、Zn属于大量元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com