
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO 、SO
、SO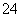 、Na+
、Na+
B.水电离出的c(H+)=10-12 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的水溶液中:NH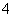 、Al3+、NO
、Al3+、NO 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO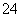 、SCN-
、SCN-
科目:高中化学 来源: 题型:
丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1g/mL,沸点约55oC,分离水和丙酮时最合理的方法是 ( )
A.蒸发 B.蒸馏 C.过滤 D.分液
查看答案和解析>>
科目:高中化学 来源: 题型:
现将0.04 mol·L-1的某酸(A)溶液和0.02 mol·L-1 NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是________;若A为HCl,100℃时(KW=10-12),溶液中由水电离出的H+浓度为________mol·L-1;若A为H2S,Q接近中性,则HS-的电离能力________水解能力(填“>”、“<”、“=”或“无法确定”)。
(2)根据(1)中信息比较相同条件下,浓度均为0.01 mol·L-1的①NaHS、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为________(填序号)。
(3)用浓度为0.01 mol·L-1的NaOH溶液滴定相同体积、相同浓度的①HCl溶液、②CH3COOH溶液、③H2S溶液,当滴定至中性时,消耗NaOH溶液的体积分别为a mL、b mL、c mL,则a、b、c的大小关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.滴加甲基橙显红色的溶液:Fe3+、NH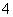 、Cl-、SCN-
、Cl-、SCN-
B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO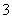
C.水电离出来的c(H+)=10-13 mol/L的溶液:K+、HCO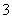 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、CO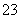 、NO
、NO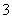 、Pb2+
、Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2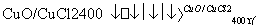 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中, 4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

①H2O的电子式是________。
②反应A的热化学方程式是___________________________________________________________________。
③断开1 mol HO键与断开 1 mol HCl键所需能量相差约为________kJ,H2O中HO键比HCl中HCl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl)∶n(O2),分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为2∶1、温度为400 ℃时,平衡混合气中Cl2的物质的量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有等浓度的下列物质的溶液:①CH3COOH,②HClO,③NaClO,④H2CO3,⑤Na2CO3,⑥NaHCO3。按溶液pH由小到大排列正确的是( )
A.④①②⑤⑥③ B.④①②⑥⑤③
C.①④②⑥③⑤ D.①④②③⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末收集到氢气1.12 L(已换算为标准状况),在此之后,又经过4 min,铁粉完全溶解。求:
(1)在前2 min内用FeCl2表示的平均反应速率;
(2)在后4 min内用HCl表示的平均反应速率;
(3)前2 min与后4 min相比,反应速率哪个较快?
查看答案和解析>>
科目:高中化学 来源: 题型:
符合如图所示的热化学方程式是( )
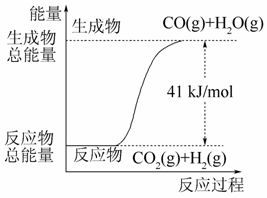
A.CO+H2O===CO2+H2 ΔH=+41 kJ/mol
B.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ/mol
C.CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ/mol
D.CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=-41 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com