
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2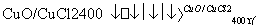 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中, 4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

①H2O的电子式是________。
②反应A的热化学方程式是___________________________________________________________________。
③断开1 mol HO键与断开 1 mol HCl键所需能量相差约为________kJ,H2O中HO键比HCl中HCl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl)∶n(O2),分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为2∶1、温度为400 ℃时,平衡混合气中Cl2的物质的量分数是________。
【解析】 (1)①H2O为共价化合物,其电子式为H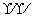
 H。②根据4 mol HCl被氧化放出115.6 kJ的热量,又结合反应条件为400℃,故其热化学方程式为4HCl(g)+O2(g)
H。②根据4 mol HCl被氧化放出115.6 kJ的热量,又结合反应条件为400℃,故其热化学方程式为4HCl(g)+O2(g)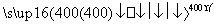 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ/mol。③根据②的热化学反应方程式和O2、Cl2的键能可知,断裂4 mol HCl键与1 mol OO键需吸收的能量比生成2 mol ClCl键和4 mol OH键放出的能量少115.6 kJ,故4 mol OH键的键能比4 mol Cl-H键的键能大:115.6 kJ+498 kJ-2×243 kJ=127.6 kJ,故断开1 mol HO键与断开1 mol HCl键所需能量相差约为127.6 kJ÷4≈32 kJ;根据OH键键能大于HCl键键能可知,OH键比HCl键强。
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ/mol。③根据②的热化学反应方程式和O2、Cl2的键能可知,断裂4 mol HCl键与1 mol OO键需吸收的能量比生成2 mol ClCl键和4 mol OH键放出的能量少115.6 kJ,故4 mol OH键的键能比4 mol Cl-H键的键能大:115.6 kJ+498 kJ-2×243 kJ=127.6 kJ,故断开1 mol HO键与断开1 mol HCl键所需能量相差约为127.6 kJ÷4≈32 kJ;根据OH键键能大于HCl键键能可知,OH键比HCl键强。
(2)①根据O2越多HCl的转化率越大,可知a、b、c、d曲线的投料比分别为6∶1、4∶1、2∶1、1∶1。②根据曲线可知,当b、c、d曲线HCl达到相同转化率时,投料比越高,对应的反应温度越低。
③设n(HCl)=2 mol,n(O2)=1 mol,根据反应曲线可知,当温度为400℃时,HCl的转化率为80%,则有:
4HCl + O2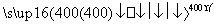 2Cl2 + 2H2O
2Cl2 + 2H2O
开始: 2 mol 1 mol 0 0
变化: 1.6 mol 0.4 mol 0.8 mol 0.8 mol
平衡: 0.4 mol 0.6 mol 0.8 mol 0.8 mol
因此平衡混合气中Cl2的物质的量分数是
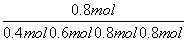 ×100%≈30.8%。
×100%≈30.8%。
【答案】 (1)①H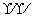
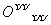
 H
H
②4HCl(g)+O2(g)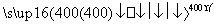 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ/mol ③32 强
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ/mol ③32 强
(2)①4∶1 ②投料比越高,对应的反应温度越低 ③30.8%


科目:高中化学 来源: 题型:
常温下,向20 mL 0.1 mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是( )
A.V(NaOH)=10 mL时,溶液中存在c(Na+)=2c(H2T)+2c(HT-)+2c(T2-)
B.V(NaOH)=20mL时,溶液中存在c(Na+)>c(HT-)>c(H+)>c(H2T)>c(T2-)
C.V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+)
D.V(NaOH)=40mL时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是
( )
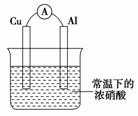
A.Cu是原电池的负极
B.Al是原电池的负极
C.电子由Al沿导线流向铜
D.铝片上的电极反应式为:Al-3e-===Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
电解原理在化学工业中有着广泛的应用。现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:
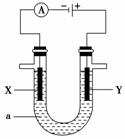
(1)若X、Y均为惰性电极,a为饱和NaCl溶液,则电解时。检验Y电极反应产物的方法是_____________________________________________________
___________________________________________________________________。
(2)若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中可观察到的现象为___________________________________________________________________。
(3)若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO 、SO
、SO 、Na+
、Na+
B.水电离出的c(H+)=10-12 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的水溶液中:NH 、Al3+、NO
、Al3+、NO 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.水的离子积常数量KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH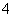 )/c(NH3·H2O)的值增大
)/c(NH3·H2O)的值增大
D.室温下,CH3COOH的KW=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量6 mol·L-1的盐酸 B.加入少量醋酸钠固体
C.加热 D.加入少量金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)CH3OH(g) ΔH<0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中可能利于提高CO的转化率的是__________(填字母)。
A.升高温度 B.增大压强
C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡__________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是__________________________。
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
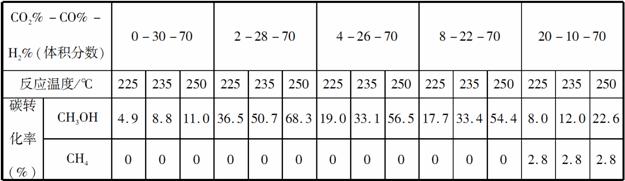
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________ _______________________________________________。
结论二:_______________________________________________ _____________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com