
常温下,向20 mL 0.1 mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是( )
A.V(NaOH)=10 mL时,溶液中存在c(Na+)=2c(H2T)+2c(HT-)+2c(T2-)
B.V(NaOH)=20mL时,溶液中存在c(Na+)>c(HT-)>c(H+)>c(H2T)>c(T2-)
C.V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+)
D.V(NaOH)=40mL时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
解析:本题考查离子浓度大小比较,考查考生对水溶液中离子平衡理论的理解能力。难度较大。
A项,V(NaOH)=10 mL时,反应前n(H2T)∶n(NaOH)=2∶1,根据物料守恒,有2c(Na+)=c(H2T)+c(HT-)+c(T2-);B项,V(NaOH)=20 mL时,反应前n(H2T)∶n(NaOH)=1∶1,反应后得到含2×10-3 mol NaHT的溶液,此时溶液呈酸性,HT-的电离程度大于水解程度,则c(Na+)>c(HT-)>c(H+)>c(T2-)>c(H2T);C项,V(NaOH)=30 mL时,反应后得到均含1×10-3 mol NaHT和Na2T的混合溶液,此时溶液呈酸性,NaHT的电离程度大于Na2T的水解程度,则c(Na+)>c(T2-)>c(HT-)>c(H+)>c(OH-);D项,V(NaOH)=40 mL时,反应后得到含2×10-3 mol Na2T的溶液,根据质子守恒有c(OH-)=c(HT-)+2c(H2T)+c(H+)。
答案:D


科目:高中化学 来源: 题型:
能将NH4NO3、Na2SO4、KCl、(NH4)2SO4四种溶液一步加以区别(可以加热)的试剂为( )
A.BaCl2 B.Ba(NO3)2 C.Ba(OH)2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.同温同压下,物质的物质的量相等,其体积一定相同
B.等体积的二氧化碳和一氧化碳所含的分子数一定相等
C.1L氮气一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,在指定的环境中能够大量共存的是( )
| 选项 | 指定环境 | 能够共存的离子 |
| A | 滴加酚酞显红色的溶液 | K+、S2-、SO |
| B | 有HCO | Na+、K+、Cl-、Al3+ |
| C | 水电离的c(H+)=10-12 mol·L-1的溶液中 | Cl-、CO NO |
| D | 使石蕊变红的溶液中 | Fe2+、MnO NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一容器中发生反应:Fe+Cu2+,Fe2++Cu,有关说法正确的是( )
A.可能为电解池反应,Fe做阴极,CuSO4溶液做电解液
B.可能为原电池反应,负极Fe被还原为Fe2+
C.可能为电解池反应,阳极反应:Fe-2e-,Fe2+
D.可能为原电池反应,Fe做负极,Zn做正极,CuSO4溶液为电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
现将0.04 mol·L-1的某酸(A)溶液和0.02 mol·L-1 NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是________;若A为HCl,100℃时(KW=10-12),溶液中由水电离出的H+浓度为________mol·L-1;若A为H2S,Q接近中性,则HS-的电离能力________水解能力(填“>”、“<”、“=”或“无法确定”)。
(2)根据(1)中信息比较相同条件下,浓度均为0.01 mol·L-1的①NaHS、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为________(填序号)。
(3)用浓度为0.01 mol·L-1的NaOH溶液滴定相同体积、相同浓度的①HCl溶液、②CH3COOH溶液、③H2S溶液,当滴定至中性时,消耗NaOH溶液的体积分别为a mL、b mL、c mL,则a、b、c的大小关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K、100 kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2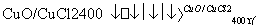 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中, 4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

①H2O的电子式是________。
②反应A的热化学方程式是___________________________________________________________________。
③断开1 mol HO键与断开 1 mol HCl键所需能量相差约为________kJ,H2O中HO键比HCl中HCl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl)∶n(O2),分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。

①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为2∶1、温度为400 ℃时,平衡混合气中Cl2的物质的量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用含少量镁的铝片制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )。
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成A1(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液生成A1(OH)3沉淀
A.①⑤⑥③ B.②③⑥③ C.②③④③ D.②③⑤③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com