
【题目】绿色化学中,最理想的“原子经济”是原子利用率为100%。下列反应类型最能体现“原子经济性”原则的是
①取代反应 ②加成反应 ③酯化反应 ④水解反应 ⑤加聚反应
A.①②B.③④C.②⑤D.②④
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂,下面是部分环烷烃及烷烃衍生物的 结构简式、键线式和某些有机化合物的反应式(其中 Pt、Ni 是催化剂)。

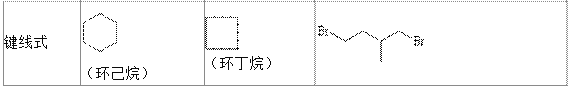
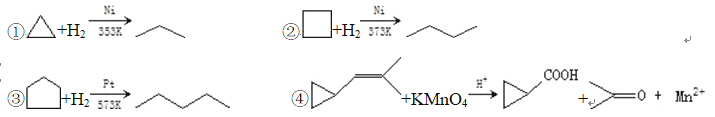
回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是____________(填名称)。判断依 据为____________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与 HBr 在一定条件下反 应,其化学方程式为____________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法.试剂____________;现象与结论____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金(质量为m g)投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是
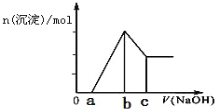
A. 假设a=25,整个反应过程中,主要发生了6个离子反应
B. c值越大,合金中Mg的含量越高
C. b值越大,合金中Al的含量越高
D. 根据图象判断,镁铝合金与50mL1mol/L的HCl溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如图的原电池,则下列说法一定错误的是( )
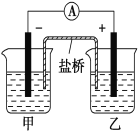
A. Cd作负极,Co作正极
B. 原电池工作时,电子从负极沿导线流向正极
C. 甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液
D. 盐桥中装有含氯化钾的琼脂,其作用是传递电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1 盐酸与 50 mL 0.55 mol·L -1 NaOH 溶液在图示的装置中进行中和反应。通过测定反应过程中的热量可计算中和热。回答下列问题:
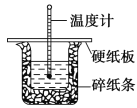
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________________
(2)烧杯间填满碎纸条的作用是______________________ 。
(3)从下列选项中选出倒入NaOH溶液的正确操作________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)大烧杯上如不盖硬纸板,求得的中和热数值将______ (填“偏 大”、“偏小”或“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1 盐酸跟 50 mL 0.55 mol·L-1 NaOH 溶液进行反应,与上述实验相比,所放出的热量________(填“变大”、“变小”或“不变”),所求中和热________(填“变大”、“变小”或“不变”)
(6)用50 mL 0.50 mol·L-1 CH3COOH 溶液(已知CH3COOH 电离时吸热)进行上述实验,测得的中和热的数值会________。(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
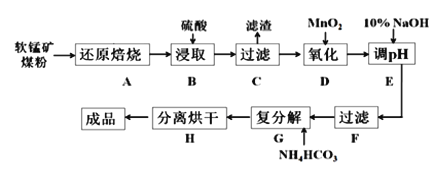
已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为____。
(2)步骤C中得到的滤渣主要成分是______________________________,步骤D中还原剂与氧化剂的物质的量之比为_____________________________。
(3)步骤E中调节pH的范围为______________________________。
(4)步骤G的离子方程式为_________________________________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=___________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:____Mn2+ +____ S2O82- + _____H2O = __________________________________,
①请完成上述离子方程式; _____________
②请描述Mn2+未完全反应时出现的现象__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制备氯气并进行一系列相关实验的装置(有些夹持设备已略)。
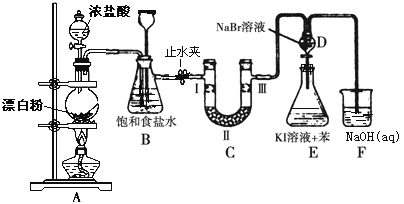
(1)写出A装置生成氯气的化学反应方程式____________________________。
(2)装置B除及吸收HCl外还有两个作用, 请写出: _________________,________________。
(3)装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号 | 1 | 2 | 3 | 4 |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 硅胶 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_______________________该现象_______(填“能”或“不能”)说明溴的非金属性强于碘,原因是____________________。
(5)有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
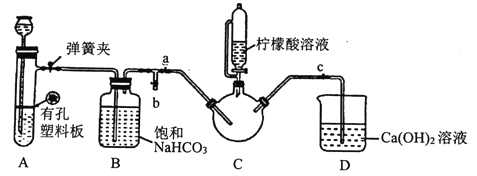
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是

A.反应②中的能量变化如图所示,则ΔH2=E1-E3
B.H2的燃烧热为241.8 kJ·mol-1
C.氨的催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
D.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com