
����Ŀ��50 mL 0.50 mol��L-1 ������ 50 mL 0.55 mol��L -1 NaOH ��Һ��ͼʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����е������ɼ����к��ȡ��ش��������⣺
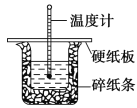
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��____________________
��2���ձ���������ֽ����������______________________ ��
��3��������ѡ����ѡ������NaOH��Һ����ȷ����________
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
��4�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ��______ (�ƫ ����ƫС������Ӱ�족)��
��5��ʵ���и���60 mL 0.50 mol��L-1 ����� 50 mL 0.55 mol��L-1 NaOH ��Һ���з�Ӧ��������ʵ����ȣ����ų�������________����������С�����䡱���������к���________����������С�����䡱��
��6����50 mL 0.50 mol��L-1 CH3COOH ��Һ(��֪CH3COOH ����ʱ����)��������ʵ�飬��õ��к��ȵ���ֵ��________��(�ƫ����ƫС������Ӱ�족)
���𰸡����β�������� ���¸��ȣ�������������ʧCƫС���ƫС
��������
(1)���������Ĺ����֪��װ��ȱ�ٵ�����Ϊ���β���������� (2)�к��Ȳⶨʵ��Ĺؼ��DZ��¹�������С�ձ�֮��������ֽ���������DZ��¸��ȣ�������������ʧ��(3)Ϊ����ȷ�ⶨ��Ӧ�����е��¶ȱ仯��������Ҫ������������Һһ�μ��룬ѡC��(4). ���ձ����������Ӳֽ�壬��ʹһ����������ʧ����õ��к�����ֵ�����С��(5)��Ӧ�ų����������������Լ�������Ķ����йأ�����60 mL 0.50 mol��L-1 ����� 50 mL 0.55 mol��L-1 NaOH ��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������ӣ����ų�������ƫ�ߣ������к��ȶ���ǿ���ǿ������1molˮʱ�������������������أ����Ը���60 mL 0.50 mol��L-1 ����� 50 mL 0.55 mol��L-1 NaOH ��Һ����ʵ�飬�ⶨ�к�����ֵ���䡣(6). ��50 mL 0.50 mol��L-1 CH3COOH ��Һ����ΪCH3COOH ����ʱ���ȣ���������ͬŨ�Ⱥ�����Ĵ���������ᣬ��Ӧ�ų�������ƫС��


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д������
A. �þƾ���Ϊ��ȡ������ˮ����ȡ��
B. ��Һʱ���²�Һ���¶��������ϲ�Һ���Ͽڵ���
C. ����ʱ���¶ȼƵ�ˮ����Ӧλ��������ƿ��֧�ܿڸ���
D. ����ʱ��©�����¶�Ҫ�����ձ����ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����и���������һ��ʵ��ͼ����ʾת����ϵ����

ѡ�� | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ձ���ʢ��Ũ HNO3�����ձ��з����õ�������������Ǧ�����缫����֪ԭ���ֹͣ����ʱ��Fe��Pb ����ʣ�࣮����˵����ȷ���ǣ� ��
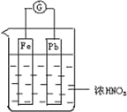
A. Fe��Pb���ã�ʼ��������
B. Fe��Ũ�����жۻ���ʼ�ղ����ܽ�
C. ���ֹͣ����ʱ���ձ���������������
D. ����Ũ�������������Һ�����ϡ���ɫ��ѧ��˼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ��ص�˵����ȷ���ǣ� ��
A.������ԭ��صĸ�����������
B.���Ӵӷ�����ԭ��Ӧ�ĵ缫����
C.ԭ����ǽ���ѧ��ת��Ϊ���ܵ�һ��װ��
D.ԭ��ص������缫��һ�����ɻ�Բ�ͬ�����ֽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��ѧ�У����������ԭ�Ӿ�������ԭ��������Ϊ100%�����з�Ӧ��������������ԭ�Ӿ�������ԭ�����
��ȡ����Ӧ�� �ڼӳɷ�Ӧ�� ��������Ӧ�� ��ˮ�ⷴӦ�� �ݼӾ۷�Ӧ
A.�٢�B.�ۢ�C.�ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������Ϊԭ�Ͽ��Ƶ�һЩ���ʡ�
(1)̼�Ȼ�ԭ���ɺϳɵ�����(AlN)
��֪��2Al2O3(s)==4Al(g)+3O2(g) ��H1=+3351KJmol��1
2C(s)+O2(g)==2CO(g) ��H2=-221KJmol��1
2Al(g)+N2(g)==2AlN(s) ��H3=-318KJmol��1
̼�Ȼ�ԭAl2O3�ϳ�AlN�����Ȼ�ѧ����ʽ��________________________________________________��
(2)��ⷨ����ȡ������ʯī���缫������� Al2O3������Na3AlF6Ϊ���ۼ���
�ٵ��ʱ����_____________��������������������
�ڵ���������������ʯī�����ģ�ԭ����________________________��
(3)������̼���黯������
����֪��Ӧ��CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)д���÷�Ӧ��ƽ�ⳣ������ʽ________________________
CH4(g)+2H2O(g)д���÷�Ӧ��ƽ�ⳣ������ʽ________________________
�ھ����ױ�����CO2�����ڼ���ˮ��Һ�е�����ɼ��飬���ɼ���ĵ缫��Ӧʽ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ�������ع�ҵ�У��������ʼ��ת����ϵ���£�

����˵������ȷ���ǣ�������
A. ��Ӧ��������������ԭ��Ӧ
B. ����ת���а����˰��������ᡢ��李�С�մ���Ĺ�ҵ��������
C. ��Ӧ���͢��еIJ��ֲ����������������ѭ������
D. ��ӦV�������Ȼ�����Һ��ͨCO2��������ͨNH3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com