
(14分)(1)氯化铝水溶液呈 性,其离子方程式表示为 ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)未用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;
此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下图方框中画出能够实验这一反应的装置图(作必要的标注);

某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
(1)酸(1分) Al3+ +3H2O Al(OH)3+3H+(2分) Al2O3 (1分)
Al(OH)3+3H+(2分) Al2O3 (1分)
(2)吸氧 (1分) 2H2O+O2+4e-=4OH-(2分) 11.2L(1分)
(3)如图 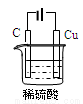 1分
1分
两极与电源的正负极接反了(或铜棒接电源的负极等)(1分)
【解析】
试题分析:(1)氯化铝溶液中铝离子水解使溶液显酸性。离子方程式为: Al3+ +3H2O Al(OH)3+3H+。氯化铝水解生成氢氧化铝和氯化氢,氯化氢有挥发性,溶液中水解得到氢氧化铝,蒸干灼烧氢氧化铝分解生成氧化铝。(2)弱酸性或中性条件下,钢铁发生吸氧腐蚀,铁做负极,碳做正极,电极反应为:2H2O+O2+4e-=4OH-。根据电极反应,此反应每转移2摩尔电子消耗0.5摩尔氧气,则体积为11.2L。(3)因为铜和硫酸通常条件下不反应,所以设计成电解池,铜连接电源的正极,做电解池的阳极,阴极用石墨,溶液用硫酸。 如果看到碳上有气泡,说明碳做电解池的阳极,铜做电解池的阴极,说明两极与电源的正负极接反了。(或铜棒接电源的负极等)(1分)
Al(OH)3+3H+。氯化铝水解生成氢氧化铝和氯化氢,氯化氢有挥发性,溶液中水解得到氢氧化铝,蒸干灼烧氢氧化铝分解生成氧化铝。(2)弱酸性或中性条件下,钢铁发生吸氧腐蚀,铁做负极,碳做正极,电极反应为:2H2O+O2+4e-=4OH-。根据电极反应,此反应每转移2摩尔电子消耗0.5摩尔氧气,则体积为11.2L。(3)因为铜和硫酸通常条件下不反应,所以设计成电解池,铜连接电源的正极,做电解池的阳极,阴极用石墨,溶液用硫酸。 如果看到碳上有气泡,说明碳做电解池的阳极,铜做电解池的阴极,说明两极与电源的正负极接反了。(或铜棒接电源的负极等)(1分)
考点:盐类的水解及应用,电化学腐蚀,电解池原理。


科目:高中化学 来源:2014-2015陕西岐山县高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
各种营养物质在人体内的消化过程正确的是
A.蛋白质在胃蛋白酶和胰蛋白酶的作用下,水解成氨基酸,氨基酸全部被吸收氧化放出能量
B.油脂直接在酶的作用下水解,同时放出能量
C.淀粉在淀粉酶的作用下最终水解成葡萄糖,葡萄糖被吸收氧化放出能量
D.维生素被吸收消化放出能量
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高一12月月考化学试卷(解析版) 题型:选择题
若20g密度为dg/cm3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是
A. mol/L B.
mol/L B. mol/L
mol/L
C.2.5d mol/L D.1.25d mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高一12月月考化学试卷(解析版) 题型:选择题
从1L1mol/LNaOH溶液中取出100ml,下列关于这100ml溶液的叙述中错误的是
A.含NaOH0.1mol B.浓度为1mol/L
C.含NaOH4g D.浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高二12月月考化学试卷(解析版) 题型:实验题
(9分)乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x的值。通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
该组同学设计了如下滴定方法测定x的值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到反应终点时消耗了10.00mL;
请回答:
(1)滴定时,将KMnO4标准溶液装在图中的 (选填“甲”或“乙”)滴定管中。

(2)本实验滴定达到终点的标志是 。
(3)通过上述数据,可计算出x= 。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (选填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。(同上)
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高二12月月考化学试卷(解析版) 题型:实验题
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项
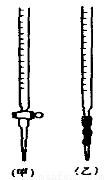
锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
A | 碱 | 酸 | 石蕊 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 石蕊 | (乙) |
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高二12月月考化学试卷(解析版) 题型:选择题
高温下,某反应达平衡,平衡常数K=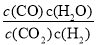 。恒容时,温度升高,H2 浓度减小。下列说法正确的是
。恒容时,温度升高,H2 浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2O 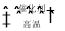 CO2 + H2
CO2 + H2
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省杭州市高二12月月考化学试卷(解析版) 题型:选择题
对于反应A(g)+3B(g)  2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.2mol/(Ls) B.v(B)=0.2 mol/(Ls)
C.v(B)=0.3mol/(Ls) D.v(C)=0.2mol/(Ls)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com