
【题目】用铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)制取铝硅合金材料有湿法、干法等方法,其中干法制备的工艺流程如下:
(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有 。
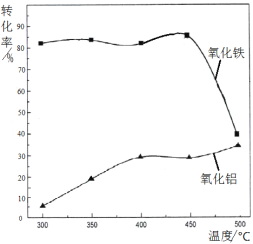
(2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3 ![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
(3)操作①包括:加水溶解、 。
(4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写一个高温下中间体与Al2O3反应生成铝单质的化学方程式 。
(5)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是 。
(6)不计损失,投入1t铝土矿,当加入54kg纯铝后,铝硅合金中m:n = 。
【答案】(1)Al3+、Fe3+、H+;(2)300℃,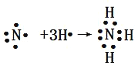 ;
;
(3)过滤;(4)Al4C3+Al2O3=6Al+3CO↑或3SiC+Al2O3=3Si+2Al+3CO↑;
(5)铁与铝形成原电池,加快了铝的腐蚀;(6)2:1。
【解析】
试题分析:(1)SiO2是酸性氧化物,不与酸反应,氧化铝表现两性,Fe2O3属于碱性氧化物,都能与酸反应,因此所得溶液中阳离子是Fe3+、Al3+、H+;(2)焙烧的目的是除去氧化铁,氧化铝转化率最低,氧化铁转化率高,因此温度控制在300℃,气体I是NH3和H2O,NH3电子式表示的过程: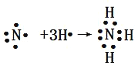 ,
,![]() ;(3)NH4Fe(SO4)2可溶,Al2O3和SiO2都不溶于水,因此加水溶解,然后过滤,得到氧化铝和二氧化硅;(4)根据信息,化学反应方程式Al4C3+Al2O3=6Al+3CO↑或3SiC+Al2O3=3Si+2Al+3CO↑;(5)铝比铁活泼,容易形成原电池,加速铝的腐蚀;(6)根据Si元素守恒,Si的质量为1×30%×28/60t=0.14t=140kg,铝土矿中铝的质量1×40.8%×54/102t=0.216t=216kg,加入54kg铝单质,铝总质量为(216+54)kg=270kg,因此m:n=(270/27):(140/28)=2:1。
;(3)NH4Fe(SO4)2可溶,Al2O3和SiO2都不溶于水,因此加水溶解,然后过滤,得到氧化铝和二氧化硅;(4)根据信息,化学反应方程式Al4C3+Al2O3=6Al+3CO↑或3SiC+Al2O3=3Si+2Al+3CO↑;(5)铝比铁活泼,容易形成原电池,加速铝的腐蚀;(6)根据Si元素守恒,Si的质量为1×30%×28/60t=0.14t=140kg,铝土矿中铝的质量1×40.8%×54/102t=0.216t=216kg,加入54kg铝单质,铝总质量为(216+54)kg=270kg,因此m:n=(270/27):(140/28)=2:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验中,①pH试纸的使用 ②过滤 ③蒸发 ④配制一定物质的量浓度溶液,均用到的仪器是
A. 蒸发皿 B. 玻璃棒 C. 试管 D. 分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.H2SO4和H3PO4的摩尔质量相等
B.2g氢气中含有1 mol氢
C.O2的摩尔质量在数值上等于其一个分子的质量
D.1 mol CO的质量是28 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是
甘油三酯 | 0.52 | mmol/L |
总胆固醇 | 4.27 | mmol/L |
高密度脂蛋白胆固醇 | 1.57 | mmol/L |
低密度脂蛋白胆固醇 | 1.40 | mmol/L |
葡萄糖 | 4.95 | mmol/L |
A.溶解度 B.物质的量浓度 C.质量分数 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡的说法中正确的是( )
,有关该平衡的说法中正确的是( )
A.升高温度,平衡常数K变大
B.增大压强,W(g)物质的量分数变大
C.升温,若混合气体的平均相对分子质量变小,则正反应放热
D.增大X浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10 s末,硫酸的浓度减少了0.6 mol/L,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是( )
A.0.02 mol/(L·s) B.1.8 mol/(L·s)
C.1.2 mol/(L·s) D.0.18 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com