
【题目】下面是几种常见的化学电源,其中属于一次电池的是( )
A. 干电池 B. 铅蓄电池 C. 燃料电池 D. 锂离子电池
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法不正确的是( )
A.氧化反应和还原反应一定同时发生
B.一定有单质参加反应
C.反应前后一定有元素的化合价发生变化
D.氧化剂一定是反应过程中得到电子的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定一种气态烃 A 的化学式,取一定量的 A 置于一密闭容器中燃 烧,定性实验表明产物是 CO2、CO 和水蒸气。学生甲、乙设计了两个方案,均认为 根据自己的方案能求出 A 的最简式,他们测得的在一定条件下的有关数据如下(图 中的箭头表示气流的方向,实验前系统内的空气已排尽):
甲:燃烧产物先通过浓硫酸,浓硫酸增重2.52克,再通过碱石灰,碱石灰增重1.32克,最后将剩余的气体点燃又生成二氧化碳1.76克
乙:燃烧产物先通过碱石灰,碱石灰增重5.60克,再通过灼热的氧化铜,氧化铜减轻0.64克,最后将通过灼热的氧化铜后出来的气体通入过量的石灰水,石灰水增重4克。
(1)甲、乙两方案中,你认为哪种方案能求出A的最简式?
(2)请根据你选择的方案,通过计算求出 A 的最简式。(要求写出计算过程)
(3)若要确定A的分子式,是否需要测定其它数据?并说明原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)制取铝硅合金材料有湿法、干法等方法,其中干法制备的工艺流程如下:
(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有 。
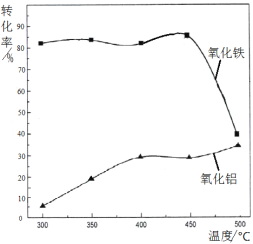
(2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3 ![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
(3)操作①包括:加水溶解、 。
(4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写一个高温下中间体与Al2O3反应生成铝单质的化学方程式 。
(5)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是 。
(6)不计损失,投入1t铝土矿,当加入54kg纯铝后,铝硅合金中m:n = 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的变化过程中有共价键明显被破坏的是( )
①I2升华 ②氯化钠溶于水 ③氯化氢溶于水 ④碳酸氢铵中闻到了刺激性气味
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质发生变化所克服的粒子间的作用力属于同种类型的是( )
A. 氯化铵受热气化和苯的气化
B. 碘和干冰受热升华
C. 二氧化硅和生石灰的熔化
D. 氯化钠和铁的熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的说法中,不正确的是( )
A. SO2是酸性氧化物
B. SO2是形成酸雨的主要污染物之一
C. SO2与水反应生成H2SO4
D. 高温下SO2可被催化氧化生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) △H1=-49.58 kJmol-1
CH3OH(g) +H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+ H2(g) ![]() CO (g)+H2O(g) △H2
CO (g)+H2O(g) △H2
反应Ⅲ:CO(g)+2 H2(g) ![]() CH3OH(g) △H 3=-90.77 kJmol-1
CH3OH(g) △H 3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅲ自发进行条件是 (填“低温”、“高温”或“任何温度”)。
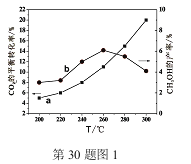
(2)某研究小组将一定量的H2和CO2充入恒容密闭容器中,在合适的催化剂条件下发生了反应I、Ⅱ、Ⅲ,不同温度下体系达到平衡时测得CO2的转化率(a)及CH3OH的产率(b)变化如图1所示。
①该反应达到平衡后,为再提高反应速率同时提高甲醇的生成量,可采取的措施有 。
A改用高效催化剂 B升高温度 C缩小容器体积 D分离出甲醇 E增加CO2的浓度
②据图1,当温度高于260℃时,CO2的平衡转化率随温度的升高继续增加,而CH3OH的产率却反而下降,请说明理由 。
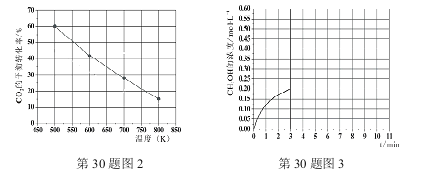
(3)已知:在2L恒容密闭容器中充入3mol H2和1.5mol CO2(一定条件下,仅考虑发生反应Ⅰ),实验测得在不同温度下,反应体系中CO2的平衡转化率与温度的关系曲线如图2所示。实验测得:在500K时,反应Ⅰ经10min时达到平衡,假如其他条件不变,当反应时间进行到3min时,迅速将反应温度升至600K进行实验,请在图3中画出3~10min内容器中CH3OH浓度的后续变化总趋势图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com