
����Ŀ����CO2�Ʊ��״����̿����漰��Ӧ���£�
��Ӧ����CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ��H1=��49.58 kJmol-1
CH3OH(g) +H2O(g) ��H1=��49.58 kJmol-1
��Ӧ����CO2(g)+ H2(g) ![]() CO (g)+H2O(g) ��H2
CO (g)+H2O(g) ��H2
��Ӧ����CO(g)+2 H2(g) ![]() CH3OH(g) ��H 3=��90.77 kJmol-1
CH3OH(g) ��H 3=��90.77 kJmol-1
�ش��������⣺
��1����Ӧ������H2= ����Ӧ���Է����������� ������¡��������¡����κ��¶ȡ�����
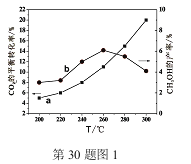
��2��ij�о�С�齫һ������H2��CO2��������ܱ������У��ں��ʵĴ��������·����˷�ӦI������������ͬ�¶�����ϵ�ﵽƽ��ʱ���CO2��ת���ʣ�a����CH3OH�IJ��ʣ�b���仯��ͼ1��ʾ��
���÷�Ӧ�ﵽƽ���Ϊ����߷�Ӧ����ͬʱ��״������������ɲ�ȡ�Ĵ�ʩ�� ��
A���ø�Ч���� B�����¶� C��С������� D������״� E����CO2��Ũ��
����ͼ1�����¶ȸ���260��ʱ��CO2��ƽ��ת�������¶ȵ����������ӣ���CH3OH�IJ���ȴ�����½�����˵������ ��
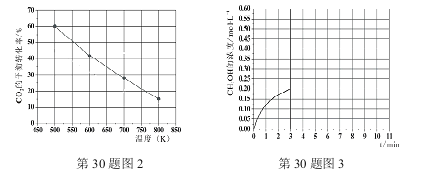
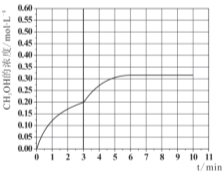
��3����֪����2L�����ܱ������г���3mol H2��1.5mol CO2��һ�������£������Ƿ�����Ӧ������ʵ�����ڲ�ͬ�¶��£���Ӧ��ϵ��CO2��ƽ��ת�������¶ȵĹ�ϵ������ͼ2��ʾ��ʵ���ã���500Kʱ����Ӧ����10minʱ�ﵽƽ�⣬���������������䣬����Ӧʱ����е�3minʱ��Ѹ�ٽ���Ӧ�¶�����600K����ʵ�飬����ͼ3�л���3��10min��������CH3OHŨ�ȵĺ����仯������ͼ��
���𰸡���1����H 2=+41.19 kJmol-1��2�������£�1�֣�
��2����CE��2�֣� ��˵���¶ȸ���260��ʱ��CO2��ת��������������CO��1�֣�����Ϊ����ӦIΪ���ȷ�Ӧ���¶����߲�����CO2ת��Ϊ�״�����Ӧ��I��ܽϵͣ���1�֣�����ӦIIΪ���ȷ�Ӧ���¶���������CO2ת��ΪCO����ӦII����ܽϸߣ���1�֣�
��3����2�֣�����Ҫ�㣺����������յ���0.315���ң���Ҫ��10min֮ǰ�ﵽƽ�����ƽ̨��
��������
�����������1����Ӧ����CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ��H1=��49.58 kJmol-1����Ӧ����CO2(g)+ H2(g)
CH3OH(g) +H2O(g) ��H1=��49.58 kJmol-1����Ӧ����CO2(g)+ H2(g) ![]() CO (g)+H2O(g) ��H2����Ӧ����CO(g)+2 H2(g)
CO (g)+H2O(g) ��H2����Ӧ����CO(g)+2 H2(g) ![]() CH3OH(g) ��H 3=��90.77 kJmol-1�����ݸ�˹��������Ӧ��=��Ӧ��-��Ӧ����������H2=��H1-��H3=49.58kJ��mol-1-��-90kJ��mol-1��=+41.19 kJmol-1����Ӧ��Ϊ�ؼ��ķ�Ӧ����S<0����Ӧ�Է�����������G=��H-T��S������Ҫ�Է�������Ҫ�ڽϵ��¶��½��С�
CH3OH(g) ��H 3=��90.77 kJmol-1�����ݸ�˹��������Ӧ��=��Ӧ��-��Ӧ����������H2=��H1-��H3=49.58kJ��mol-1-��-90kJ��mol-1��=+41.19 kJmol-1����Ӧ��Ϊ�ؼ��ķ�Ӧ����S<0����Ӧ�Է�����������G=��H-T��S������Ҫ�Է�������Ҫ�ڽϵ��¶��½��С�
��2����A�����ø�Ч�������ܼӿ췴Ӧ���ʣ����̵���ƽ���ˮ�⣬���Dz�Ӱ��ƽ����ƶ����״����������䣬����B�������¶ȣ��ӿ췴Ӧ���ʣ�����ӦΪ���ȷ�Ӧ��ƽ�������ƶ����״���������С��B����C����С�������������ѹǿ���ӿ췴Ӧ���ʣ�ƽ�������ƶ����״�����������C��ȷ��D��������״���ƽ�������ƶ����״�������������Ӧ���ʼ�����C����E������CO2��Ũ�ȣ����Լӿ췴Ӧ������ʹ��ƽ�������ƶ����״�����������E��ȷ����ѡCE��
�����¶ȸ���260��ʱ��CO2��ƽ��ת�������¶ȵ����������ӣ���CH3OH�IJ���ȴ�����½���˵���¶ȸ���260��ʱ��CO2��ת��������������CO����Ϊ����ӦIΪ���ȷ�Ӧ���¶����߲�����CO2ת��Ϊ�״�����Ӧ��I��ܽϵͣ�����ӦIIΪ���ȷ�Ӧ���¶���������CO2ת��ΪCO����ӦII����ܽϸߣ���
��3��3minʱδ����ƽ�⣬��ʱѸ�ٽ���ϵ�¶�����600K��˲��״���Ũ�Ȳ��䣬��Ӧ���ʼӿ죬����ƽ���ʱ��С��10min�������¶�Ϊ600K�������£�����3mol H2��1.5mol CO2��ƽ��ʱ������̼��ת����Լ��42%����ƽ��ʱ�״������ʵ���Լ��1.5mol��42%=0.63mol����ƽ��ʱ�״���Ũ��Լ��0.315mol/L��3��10min��������CH3OHŨ�ȵı仯��������Ϊ��


 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǽ��ֳ����Ļ�ѧ��Դ����������һ�ε�ص���( )
A. �ɵ�� B. Ǧ���� C. ȼ�ϵ�� D. ����ӵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaHCO3��Na2CO3��xH2O�Ļ���Ϊ�˲ⶨxֵ��ijͬѧ������ͼ��ʾ��װ�ý���ʵ��(CaCl2����ʯ�Ҿ�����)��

(1)Aװ�õ�������____________________________��
(2)Bװ�õ�������____________________________��
(3)Cװ�õ�������___________________________��
(4)����װ��A���Թ���װ��NaHCO3��Na2CO3��xH2O�Ļ����3.7 g���þƾ��Ƽ��ȵ���Ӧ��ȫ����ʱB������1.89 g��C������0.22 g����x��ֵΪ__________________��
(5)��װ�û����Ǻ����ƣ�����ʹ�ⶨ���ƫС��Ӧ��θĽ�________________��Ϊʲô��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϡ����ķ�Ӧ�У���֪10 sĩ�������Ũ�ȼ�����0.6 mol/L���������Ƿ�Ӧ��������Һ����ı仯����10 s��������������ƽ����Ӧ�������� ��
A��0.02 mol/��L��s�� B��1.8 mol/��L��s��
C��1.2 mol/��L��s�� D��0.18 mol/��L��s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ�Ͽ���CO2������ȼ�ϼ״����йط�ӦΪ��
CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H����49.0 kJ��mol��1���������Ϊ1L���ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH��g��+H2O��g�� ��H����49.0 kJ��mol��1���������Ϊ1L���ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH��g����Ũ����ʱ��ı仯��ͼ��ʾ��
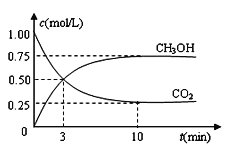
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ��Ũ��ΪC��H2����_____________��
��2�����ı�����ʹƽ��������Ӧ�����ƶ�����ƽ�ⳣ��______________���������
a�����ܲ��� b�����ܼ�С c���������� d�����䡢��С��������п���
��3���ܹ�˵���÷�Ӧ�Ѵﵽƽ�����__________������ĸ���,��ͬ����
A.���¡�����ʱ,�����ڵ�ѹǿ���ٱ仯
B.���¡�����ʱ,�����ڻ��������ܶȲ��ٱ仯
C.һ��������,CO2��H2��CH3OH��Ũ�ȱ��ֲ���
D.һ��������,��λʱ��������3molH2��ͬʱ����1mol CH3OH
��4���������������������£�����ϵ���ѹ����ԭ���Ķ���֮һ�������йظ���ϵ��˵����ȷ����________��
a��������Ũ�ȼ�С b������Ӧ���������淴Ӧ����Ҳ����
c���״������ʵ������� d������ƽ��ʱn��H2��/n��CH3OH������
��5������¶���T���¸÷�Ӧ��ƽ�ⳣ��K= ________������ʼʱ���1L�ܱ������г���1mol CO2,2mol H2,1.5mol CH3OH��1mol H2O��g��,��Ӧ��________����������������������Ӧ������С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. s���������ڿռ������������չ�̶���ͬ�ĶԳ���״
B. p�����Ƶ���״�ǶԶ�˫��
C. L���Ӳ���d���
D. 2p�����һ��δ�ɶԵ��ӵĻ�̬ԭ�Ӻͼ۵����Ų�Ϊ2s22p5��ԭ����ͬ��Ԫ�ص�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�ӵĵ�n����Ӳ��У�����Ϊ������Ӳ�ʱ��������ɵĵ�������(n��1)����ͬ������Ϊ�����ʱ��������ɵĵ�������(n��1)�������10�����ӣ���˵��Ӳ�Ϊ( )
A. K�� B. L�� C. M�� D. N��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե�n���Ӳ㣬������Ϊԭ�ӵ�����㣬�����ɵĵ����������(n��1)�����ͬ��������Ϊ����㣬�������ɵĵ�������(n��1)���ϵ���������ܶ�10������ô��n��Ϊ��
A. L�� B. M�� C. N�� D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������CH4��N2��ɣ���û�������ڱ�״���µ��ܶ�Ϊ0.893g/L������������N2��CH4�����֮��Ϊ
A��1��2 B��1��4 C��2��1 D��4��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com